
| A、剧烈燃烧,产生大量白烟 |
| B、产生棕红色的浓烟 |
| C、产生苍白色的火焰 |
| D、产物溶于水,溶液呈浅绿色 |
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
| A、.先有S生成 |
| B、.先有I2生成 |
| C、.先有Br2生成 |
| D、.以上结论均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
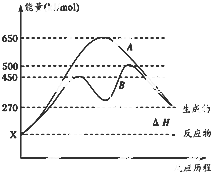 (1)已知:①Fe(s)+
(1)已知:①Fe(s)+| 1 |
| 2 |
| 3 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、N2和H2在点燃或光照条件下可合成氨 |
| B、氨是共价化合物,硝酸是离子化合物 |
| C、氨气遇到浓硝酸会发生反应产生白烟 |
| D、由氨制取硝酸过程中,氮元素被还原 |
查看答案和解析>>
科目:高中化学 来源: 题型:
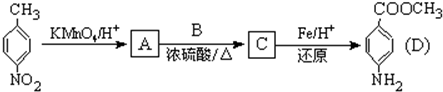
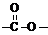 结构的基团的C的所有同分异构体的结构简式:
结构的基团的C的所有同分异构体的结构简式: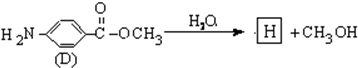
查看答案和解析>>
科目:高中化学 来源: 题型:
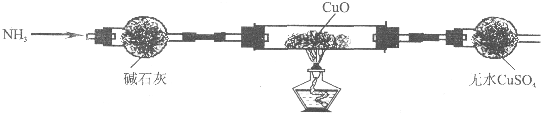
查看答案和解析>>
科目:高中化学 来源: 题型:
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡时甲、乙中C的体积分数甲>乙 |
| B、平衡时甲中A的转化率为60% |
| C、达到平衡后,再向乙中加入0.8molA+1.2molB+1.2molC,平衡向生成A的正向移动 |
| D、D甲容器达到平衡后,升温,反应的平衡常数增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
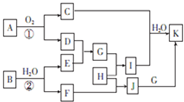 物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.
物质A~K有如图所示的转化关系(反应条件及部分产物未列出)其中A由两种元素组成,且两种元素的质量之比为7:8,B是非金属固态单质,G是金属单质,H是黄绿色气体,D为红棕色固体,C是形成酸雨的主要气体.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com