
A、B、C、D、E五种短周期元素,A 与D同周期,A的单质既可与盐酸反应,又可与NaOH溶液反应,B的单质在放电条件下能与氧气反应,C元素的离子不含电子,D元素原子的最外层电子数是其次外层电子数的3/4,E元素原子的最外层电子数是其次外层电子数的3倍。
(1)A的原子结构示意图为 。
(2)0.1 mol/L A的硫酸盐溶液与0.1 mol/L NaOH溶液等体积混合,反应的离子
方程式为 。
(3)以A的单质和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)转化为Ni(OH)2,该电池总反应的化学方程式是 。
(4)化合物甲由元素A、B组成,具有良好电绝缘性。
化合物甲能与水缓慢反应生成含B的化合物乙,乙分子中含有10个电子。写出该反应的化学方程式: 。
工业用A的单质和化合物乙在高于1700K反应制备甲。已知该反应可以认为是置换反应,该反应的化学方程式是 。
(5)D和E两种元素相比较,非金属性较强的是(填元素名称) ,可以验证该结论的是(填写编号) ;
a.比较这两种元素的常见单质的沸点
b.比较这两种元素的单质与氢气化合的难易
c.比较这两种元素的气态氢化物的稳定性
(6)C、D、E间可形成丙、丁两种分子,它们均含有18个电子,则丙与丁反应生成D单质的化学方程式为 ;
科目:高中化学 来源: 题型:
下列说法正确的是
A.将NaH溶于水,得到的水溶液能导电说明NaH是离子化合物
B.Fe(OH)3胶体和Fe(OH)3沉淀的化学性质不相同
C.乙醇分子中含羟基,可与金属钠反应生成氢气
D.MnO2具有较强氧化性,可作为H2O2分解反应的氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学在实验室中准备利用Na2S2O3溶液和稀H2SO4来验证浓度、温度对反应速率的影响。
【实验药品及仪器】:0.1 mol·L-1的Na2S2O3溶液、0.1 mol·L-1的稀H2SO4、、热水、冷水、蒸馏水、量筒、烧杯、试管(若干)、胶头滴管等。
【实验步骤】:
(1)写出反应的方程式
(2)验证浓度对反应速率的影响:
该同学想通过改变Na2S2O3的浓度来验证浓度对反应速率的影响。为了得到令人信服的实验结果,你认为他在实验中必须做到一致的几个因素是①
② ……(可不填满,也可补充)。
(3)验证温度对反应速率的影响:
该同学在两个烧杯中放入了等量的适量的热水和冷水,为了得到令人信服的实验结果,你认为他在实验中必须做到一致的几个因素是①
② ……(可不填满,也可补充)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于同温同压下的两种气体12C18O和14N2的判断正确的是
A.体积相等时密度相等 B.原子数相等时具有的中子数相等
C.体积相等时具有的电子数相等 D.质量相等时具有的质子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2 +Pb+2H2SO4= 2PbSO4+2H2O,根据此反应判断下列叙述中正确的是
A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO42--2e– = PbSO4
C.PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下恒容容器内反应2AB(g)  A2(g)+B2(g)达到平衡状态的标志是( )
A2(g)+B2(g)达到平衡状态的标志是( )
A.单位时间内生成nmol A2 ,同时消耗2n mol AB
B.反应混合气体总压强不随时间而变化
C.反应混合气体密度不随时间而变化
D.容器中各组分的质量分数不随时间而变化
查看答案和解析>>
科目:高中化学 来源: 题型:
T ℃时在2L容积不变的密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Y的体积百分含量与时间的关系如图2所示。则下列结论错误的是( )
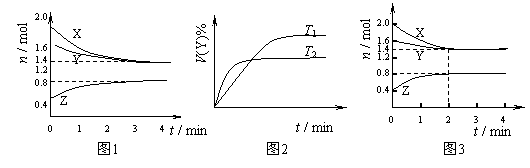
A.容器中发生的反应可表示为:3X(g)+Y(g) 
 2Z(g)
2Z(g)
B.保持其他条件不变,升高温度,化学平衡向逆反应方向移动
C.反应进行前4 min内,用X表示的反应速率 v(X)=0.075mol•(L•min) -1
D.若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中可能含有下列5种离子中的几种:Na+、NH4+、Mg2+、Al3+、Cl-。为确认该溶液组成进行如下实验:①取20.0 mL该溶液,加入32.5 mL 4.00 mol•L-1 NaOH溶液加热,有白色沉淀产生,无刺激气味气体生成.过滤、洗涤、干燥,得沉淀2.03 g。再将滤液稀释至100mL,测得滤液中c(OH-)=0.2 mol•L-1;②另取20.0 mL该溶液,加入足量的AgNO3溶液,生成白色沉淀14.35 g。关于原溶液组成结论正确的是
A.一定含有Mg2+、Al3+、Cl-,不含有Na+、NH4+
B.一定含有Na+、Mg2+、Cl-,不含有NH4+、可能含有Al3+
C.c(Mg2+)为1.75 mol•L-1,c(Na+)为1.50 mol•L-1
D.c(Cl-)为5.00 mol•L-1,c(Al3+)为1.00 mol•L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com