

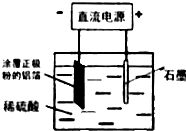
分析 含钴废催化剂(主要成分为Co、Fe,SiO2杂质不与硫酸反应)中加入稀硫酸酸浸然后过滤,Co、Fe和稀硫酸反应生成硫酸盐,SiO2不反应,然后过滤,向滤液中加入NaClO3,发生氧化还原反应,离子方程式为ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,向溶液中加入Na2CO3并调节溶液的pH然后过滤,发生的反应方程式为3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,然后向滤液中加入碳酸钠、草酸铵,然后过滤得到草酸钴,通入氧气并灼烧草酸钴,得到二氧化碳和钴氧化合物,n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,根据C原子守恒得n(CoC2O4)=$\frac{1}{2}$n(CO2)=0.03mol,根据Co原子守恒得n(Co)=n(CoC2O4)=0.03mol,m(Co)=0.03mol×59g/mol=1.77g,则钴氧化物中n(O)=$\frac{(2.41-1.77)g}{16g/mol}$=0.04mol,所以钴氧化物化学式为Co3O4;
钴氧化合物和碳酸锂、氧气发生氧化还原反应6Li2CO3+4Co3O4+O2=12LiCoO2+6CO2,得到固体LiCoO2,
(1)第Ⅰ步在过滤后,将滤渣洗涤2-3次,洗液与滤液合并,能减少Co元素的损失;
(2)用硝酸酸化的硝酸银溶液检验氯离子;
(3)Na2CO3和硫酸铁发生反应生成[Na2Fe6(SO4)4(OH)12]沉淀;
(4)根据盖斯定律计算反应热;
(5)n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,根据C原子守恒得n(CoC2O4)=$\frac{1}{2}$n(CO2)=0.03mol,根据Co原子守恒得n(Co)=n(CoC2O4)=0.03mol,m(Co)=0.03mol×59g/mol=1.77g,则钴氧化物中n(O)=$\frac{(2.41-1.77)g}{16g/mol}$=0.04mol,所以钴氧化物化学式为Co3O4;
钴氧化物和碳酸锂、氧气发生氧化还原反应生成二氧化碳和LiCoO2;
(6)阴极上氢离子得电子生成氢气,阳极上氢氧根离子失电子生成氧气,所以两极均得到气体,阴极上LiCoO2得电子和氢离子反应生成Co2+.
解答 解:含钴废催化剂(主要成分为Co、Fe,SiO2杂质不与硫酸反应)中加入稀硫酸酸浸然后过滤,Co、Fe和稀硫酸反应生成硫酸盐,SiO2不反应,然后过滤,向滤液中加入NaClO3,发生氧化还原反应,离子方程式为 ClO3-+6Fe2++6H+=6Fe3++Cl-+3H2O,向溶液中加入Na2CO3并调节溶液的pH然后过滤,发生的反应方程式为3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,然后向滤液中加入碳酸钠、草酸铵,然后过滤得到草酸钴,通入氧气并灼烧草酸钴,得到二氧化碳和钴氧化合物,n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,根据C原子守恒得n(CoC2O4)=$\frac{1}{2}$n(CO2)=0.03mol,根据Co原子守恒得n(Co)=n(CoC2O4)=0.03mol,m(Co)=0.03mol×59g/mol=1.77g,则钴氧化物中n(O)=$\frac{(2.41-1.77)g}{16g/mol}$=0.04mol,所以钴氧化物化学式为Co3O4;
钴氧化合物和碳酸锂、氧气发生氧化还原反应6Li2CO3+4Co3O4+O2=12LiCoO2+6CO2,得到固体LiCoO2,
(1)第Ⅰ步在过滤后,将滤渣洗涤2-3次,洗液与滤液合并,能减少Co元素的损失,从而提高钴等元素的利用率,故答案为:提高钴等元素的利用率;
(2)用硝酸酸化的硝酸银溶液检验氯离子,其检验方法为取少量该生成液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-
,
故答案为:取少量该生成液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中滴加HNO3酸化,再加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-;
(3)Na2CO3和硫酸铁发生反应生成[Na2Fe6(SO4)4(OH)12]沉淀,反应方程式为3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑,故答案为:3Fe2(SO4)3+6H2O+6 Na2CO3=Na2Fe6(SO4)4(OH)12↓+5 Na2SO4+6CO2↑;
(4)①CH3OH (1)+O2(g)=CO(g)+2H2O(g)△H1=-354.8kJ/mo1
②2CO2(g)=2CO(g)+O2(g)△H2=+566kJ/mo1,
将方程式②-2①得2CO2(g)+4H2O(g)=2CH3OH(g)+3O2(g)△H=(+566kJ/mo1)-2(-354.8kJ/mo1)=+1275.6kJ/mo1,故答案为:+1275.6;
(5)n(CO2)=$\frac{1.344L}{22.4L/mol}$=0.06mol,根据C原子守恒得n(CoC2O4)=$\frac{1}{2}$n(CO2)=0.03mol,根据Co原子守恒得n(Co)=n(CoC2O4)=0.03mol,m(Co)=0.03mol×59g/mol=1.77g,则钴氧化物中n(O)=$\frac{(2.41-1.77)g}{16g/mol}$=0.04mol,所以钴氧化物化学式为Co3O4;
钴氧化物和碳酸锂、氧气发生氧化还原反应生成二氧化碳和LiCoO2,反应方程式为6Li2CO3+4Co3O4+O2=12LiCoO2+6CO2,
故答案为:Co3O4;6Li2CO3+4Co3O4+O2=12LiCoO2+6CO2;
(6)阴极上氢离子得电子生成氢气,阳极上氢氧根离子失电子生成氧气,所以两极均得到气体,阴极上LiCoO2得电子和氢离子反应生成Co2+,
电极反应式为LiCoO2+4H++e-=Li++Co2++2H2O和 2H++2e-=H2↑,
故答案为:LiCoO2+4H++e-=Li++Co2++2H2O; 2H++2e-=H2↑.
点评 本题考查物质分离和提纯,为高频考点,侧重考查学生分析推断及基本实验操作能力,明确流程图中发生的反应、基本操作方法、物质的性质是解本题关键,难点是(5)题钴氧化物化学式的确定,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 蒸馏常用于分离提纯液态有机混合物 | |
| B. | 核磁共振氢谱通常用于分析有机物中氢的个数 | |
| C. | 对有机物分子红外光谱图的研究有助于确定有机物分子中的官能团 | |
| D. | 燃烧法是研究确定有机物元素组成的有效方法 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同族元素中Z的氢化物稳定性最高 | |
| B. | 原子半径:X>Y,离子半径:X+>Z2- | |
| C. | 同周期元素中X的金属性最强 | |
| D. | 同周期元素中Y的最高价含氧酸的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 煤的干馏就是将煤隔绝空气在高温使之分解,得到焦炭、煤焦油等物质的过程 | |
| B. | 煤的液化就是将煤转化成甲醇、乙醇等其液态物质的过程 | |
| C. | 煤的气化就是将煤在高温条件由固态转化为气态的物理变化过程 | |
| D. | 通过催化裂化或裂解,可以获得碳原子数较少的轻质油 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
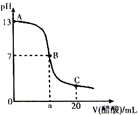 在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )
在20mL0.100mol•L-1NaOH溶液中逐滴加入0.200mol•L-1醋酸溶液,曲线如图所示,有关粒子浓度关系比较正确的是( )| A. | A点到B点的变化过程中,离子浓度大小关系:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| B. | 在B点a>10,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+) | |
| C. | B点到C点的变化过程中,离子浓度大小关系:c(CH3COO-)>c(H+)>c(Na+)>c(OH-) | |
| D. | 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ②③④ | C. | ②④ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com