
分析 (1)同分异构体是指分子式相同,但结构不同的化合物;同素异形体是指同种元素形成的不同种单质;同位素是质子数相同,中子数不同的原子;同系物是结构相似,在分子组成上相差一个或若干个CH2原子团的化合物;
(2)根据不同种元素最本质的区别是质子数不同,可推断:不同质子数,说明肯定不是同种元素的粒子;相同电子数即“核外电子数相同”,说明它们核外电子结构相同,而它们的质子数不同,说明肯定不是两种不同元素的原子的两种粒子;据此即可判定正确的选项.
解答 解:(1)CH3CH2CH2CH3和CH3CH(CH3)2分子式相同,但结构不同互为同分异构体;金刚石和石墨是同种元素形成的不同种单质,互为同素异形体;C2H6和C5H12结构相似,在分子组成上相差3个CH2原子团,互为同系物;35Cl和37Cl质子数相同,中子数,互为同位素;故答案为:D;A;B;E;
(2)A、不同元素的原子,电子数肯定不同,故A错误;
B、不同元素的离子,如Na+和Mg2+,都是离子,而且质子数不同,电子数相同,但是不同元素的原子和离子,如Ne和Na+,也是成立的,故B错误;
C、同一元素,质子数就一定相同,故C错误;
D、一种元素的原子和另一种元素的离子,可以是不同质子数、相同电子数的两种粒子,如Ne和Na+,故D正确.
故选D.
点评 本题涉及“五同概念”以及微粒的构成,解答(2)题必须理解不同质子数、相同电子数的含义,才能正确解答.


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素Q与W形成的两种常见化合物中含有相同比例的阴、阳离子,与水反应产物不完全相同 | |
| B. | 元素T、Q、W、Y的原子半径大小为:T<Q<Y<W | |
| C. | Q与Y组成的常见物质是一种两性物质,结构中含有离子键 | |
| D. | 由Y和T组成的物质YT是,在电子和陶瓷工业上有广泛应用,可以直接由单质Y和T在低温下合成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将溴乙烷与NaOH溶液混合后振荡、静置,直接向反应后的混合物中滴加AgNO3溶液,检验Br-的存在 | |
| B. | 将乙醇加热至170℃,制取乙烯 | |
| C. | 向试管中加入5 mL溴水、2 mL苯和0.5 g铁粉,充分振荡后静置,观察试管底部生成的褐色油状液体 | |
| D. | 在试管中加入约2 mL饱和溴水,然后滴入2滴~3滴苯酚稀溶液,观察苯酚与溴反应生成的白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
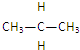 和
和 互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤.
互为同位素的是②,互为同素异形体的是①,互为同系物的是④,互为同分异构体的是③,其名称分别为正丁烷、异丁烷,互为同一物质的是⑤.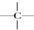 ,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)
,一个-CH2-和一个-Cl,它可能的结构简式是CH3C(CH3)2CH2Cl.(任意写出一种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 其水溶液显强酸性,俗称石炭酸 | |
| B. | 其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 | |
| C. | 其在水中的溶解度随温度的升高而增大,超过65℃可以与水以任意比互溶 | |
| D. | 碳酸氢钠溶液中滴入苯酚的水溶液后不会放出二氧化碳 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 431 kJ•mol-1 | B. | 945.6 kJ•mol-1 | C. | 649 kJ•mol-1 | D. | 896 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
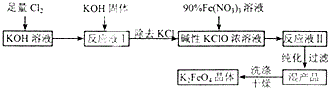 高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:
高铁酸钾(K2FeO4)是一种新型多功能水处理剂.其生产工艺如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com