
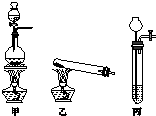
 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).
相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期.在一定条件下,X与Y化合生成M;X与Z化合生成N;M能与N化合生成A.实验室可分别用如图所示的发生装置制取X、Z和M(夹持装置已略).分析 相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期,可以判断X为H2,Z为Cl2,在一定条件下,X与Z化合生成N为HCl,X与Y化合生成M,M能与N化合生成A,则Y为N2,M为NH3,A为NH4Cl.实验室用Zn等与硫酸等制备氢气,用二氧化锰与浓盐酸再加热条件下制备氯气,利用氯化铵与氢氧化钙再加热条件下制备氨气.
解答 解:(1)相对分子质量由小到大排列的X、Y、Z三种气体单质,组成这三种单质的元素分别位于不同的短周期,可以判断X为H2,Z为Cl2,在一定条件下,X与Z化合生成N为HCl,X与Y化合生成M,M能与N化合生成A,则Y为N2,M为NH3,A为NH4Cl,
故答案为:H2;N2;Cl2;
(2)实验室用Zn等与硫酸等制备氢气,用二氧化锰与浓盐酸再加热条件下制备氯气,利用氯化铵与氢氧化钙再加热条件下制备氨气,装置甲为固+液加热制取气体装置,可以用甲装置制取Z氯气;装置乙为固+固加热制取气体装置,可以用于制取M氨气;丙为固+液不需要加热制取气体装置,可用于制取X氢气,
故答案为:丙;甲;乙;
(3)氯气能与氨气在常温下反应生成氮气,同时有白烟产生,还生成氯化铵,反应的化学方程式是:8NH3+3Cl2=6NH4Cl+N2,
故答案为:8NH3+3Cl2=6NH4Cl+N2.
点评 本题考查无机物推断、气体的制备等,“三种气体单质的元素分别位于不同的短周期”为推断突破口,熟练掌握常见气体的制备,难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①④⑤ | C. | ①③④ | D. | ①③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.
某化学兴趣小组为探究元素性质的递变规律,设计可如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 实验结论 |
| A | 用pH计测得次氯酸钠溶液的pH>7 | HClO是弱酸 |
| B | 向10mL0.1mol/L NaOH溶液中加入1mL0.1mol/LMgCl2溶液,然后再向混合溶液中滴加CuCl2溶液,产生蓝色沉淀 | 溶度积:Ksp[Mg(OH)2]>Ksp[Cu(OH)2] |
| C | 在淀粉溶液中加入稀硫酸,水浴加热,一段时间后,滴入几滴碘水,溶液变为蓝色 | 淀粉没有水解 |
| D | 在未知溶液中滴加BaCl2溶液出现白色沉淀,加稀硝酸,沉淀不溶解 | 该未知溶液中存在SO42-或SO32- |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙烯分子有7个σ键和1个π键 | |
| B. | 丙烯分子中3个碳原子都是sp2杂化 | |
| C. | 丙烯分子中3个碳原子在同一直线上 | |
| D. | 丙烯分子中既存在非极性键又存在极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将氯气通入石灰乳中制取漂白粉:Cl2+2OH-═ClO-+Cl-+H2O | |
| B. | 氯气和水的反应:C12+H2O═2H++Cl-+ClO- | |
| C. | 铜屑放入稀硝酸中:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O | |
| D. | NaClO溶液中通入过量SO2:ClO-+H2O+SO2═C1-+SO42-+2H + |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 向足量AgNO3溶液中先滴加少量NaCl溶液,后滴加少量KI溶液 | 先产生白色沉淀后又产生黄色沉淀 | AgI比AgCl更难溶 |
| B | 溴乙烷和烧碱的乙醇溶液共热 | 产生的气体可使酸性高锰酸钾溶液褪色 | 证明有乙烯生成 |
| C | 将高温水蒸气通过灼热的铁粉 | 铁粉变红 | 铁与水在高温下能发生反应 |
| D | Fe粉中加入过量的稀HNO3,充分反应后滴入几滴KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 实验数据 | 1 | 2 | 3 | 4 |
| V(样品)/ml | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)始/ml | 0.00 | 0.20 | 0.10 | 0.10 |
| V(NaOH)终/ml | 14.98 | 15.20 | 15.12 | 16.24 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com