
| 混合溶液实验 | A | B | C | D | E | F |
| 4mol•L-1H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
分析 (1)锌较活泼,可与硫酸铜、硫酸等发生置换反应;
(2)硫酸铜溶液加快氢气生成的速率,原因是形成原电池反应;
(3)如形成原电池反应,所加硫酸盐对应的金属应比锌的活泼性弱;
(4)结合浓度、温度、催化剂等因素对反应速率的影响分析;
(5)①为保证实验有对比性,只能逐渐改变一个变量分析,CuSO4溶液体积逐渐增多,故H2SO4的量应相等均为30mL,水的量减小,但每组实验中CuSO4与水的体积之和应相等;
②Zn与CuSO4溶液生成Cu会附着在锌的表面.
解答 解:(1)因为Cu2+的氧化性比H+的强,所以加入硫酸铜,Zn先跟硫酸铜反应,反应完后再与酸反应,反应的有关方程式为Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑,
故答案为:Zn+CuSO4=ZnSO4+Cu、Zn+H2SO4=ZnSO4+H2↑;
(2)锌为活泼金属,加入硫酸铜,发生Zn+CuSO4=ZnSO4+Cu,置换出铜,与锌形成原电池反应,化学反应速率加快,
故答案为:CuSO4与Zn反应产生的Cu与Zn形成铜锌原电池,加快了氢气产生的速率;
(3)Na2SO4 MgSO4 Ag2SO4 k2SO4等4种溶液中,能与锌发生置换反应且能形成原电池反应的只有Ag2SO4,
故答案为:Ag2SO4;
(4)对于溶液中的化学反应,影响反应速率的因素还有浓度、温度、催化剂以及固体表面积大小等,要加快上述实验中气体产生的速率,还可采取的措施有升高反应温度、适当增加硫酸的浓度、增加锌粒的表面积等,
故答案为:升温,增加H2SO4浓度;
(5)①要对比试验效果,那么除了反应的物质的量不一样以外,要保证其它条件相同,而且是探究硫酸铜量的影响,那么每组硫酸的量要保持相同,六组反应的总体积也应该相同.A组中硫酸为30ml,那么其它组硫酸量也都为30ml.而硫酸铜溶液和水的总量应相同,F组中硫酸铜20ml,水为0,那么总量为20ml,所以V2=10ml,V3=17.5ml,V1=30ml.
故答案为:30;10;17.5;
②当加入一定量的硫酸铜后,Zn与CuSO4溶液生成Cu会附着在锌的表面,降低了锌与溶液的接触面积,所以反应速率会降低;
故答案为:当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
点评 本题考查了影响化学反应速率的因素、化学实验探究,题目难度中等,注意把握影响速率的因素,本题的易错点在于第(5)小题,首先V1、V2、V3的求得要注意分析表中数据,侧重于考查学生的实验探究能力.


科目:高中化学 来源: 题型:选择题
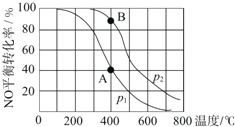 已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )
已知:2NO(g)+O2(g)?2NO2(g),其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线(如图),下列说法不正确的是( )| A. | p1<p2 | B. | 该反应的△H<0 | ||
| C. | A、B两点的平衡常数:K(A)<K(B) | D. | A、B两点的化学反应速率:v(A)<v(B) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 黑色金属材料通常包括铁、铬、铜以及它们的合金,是应用非常广泛的金属材料 | |
| B. | 烹鱼时加入少量的料酒和食醋可减少腥味,增加香味,属于物理变化 | |
| C. | 若分散质粒子直径在1nm-100nm之间,则其为胶体;放电时放映室射到银幕上的光柱的形成属于丁达尔效应 | |
| D. | Na2CO3•10H2O在干燥空气中失水和木材干馏制焦炭都属于化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
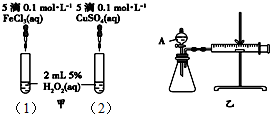 为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )
为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.下列叙述中不正确的是( )| A. | 实验中H2O2分解的速率为(1)>(2) | |
| B. | 图乙实验可通过测定相同状况下,产生的气体体积与反应时间来比较反应速率 | |
| C. | H2O2分解的热化学方程式2H2O2(l)═2H2O(l)+O2(g)△H>0 | |
| D. | 图甲中(1)、(2)两个实验中H2O2分解的△H相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol/L H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 20种 | B. | 29种 | C. | 30种 | D. | 48种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com