
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-1着 | 5.6×10-8 | 6.3×10-50 | 着.1×10-9 | 1.2×10-15 | 3.4×10-28 |
| c(H+)c(HCO-3) |
| c(H2CO3) |
| c(H+)c(HCO-3) |
| c(H2CO3) |
| 1000×1g/mL×0.117% |
| v8.vg/mol |
| 1.8×10-10 |
| 0.02 |


科目:高中化学 来源:不详 题型:单选题
| A.HX>HY>HZ | B.HZ>HY>HX | C.HY>HX>HZ | D.HY>HZ>HX |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
| ① | HF | Ka=6.8×10-4mol?L-1 |
| ② | CH3COOH | Ka=1.7×10-5mol?L-1 |
| ③ | HCN | Ka=6.2×10-10mol?L-1 |
| ④ | H2CO3 | Ka1=4.4×10-7mol?L-1 Ka2=4.7×10-11mol?L-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:多选题
| A.结合质子的能力:Y->CO32->X->HCO3- |
| B.酸性由强至弱:H2CO3>HX>HY |
| C.溶液碱性:NaX>Na2CO3>NaY>NaHCO3 |
| D.NaX溶液中通入足量CO2后的离子浓度:c(Na+)>c(X-)>c(HCO3-)>c(H+)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.开始反应时,二者的速率相等 |
| B.盐酸放出的H2多 |
| C.二者放出的H2一样多 |
| D.醋酸消耗的Zn的质量多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2.4×10-7mol/L | ||
| B.1.0×10-7mol/L | ||
C.
| ||
| D.c(OH-)无法确定 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
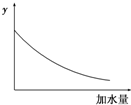
| A.溶液的pH | B.醋酸的电离平衡常数 |
| C.溶液的导电能力 | D.醋酸的电离程度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com