


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X | 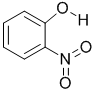 |
0.2 | 45 | 100 |
| Y | 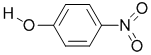 |
1.7 | 114 | 295 |
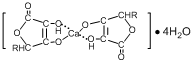
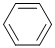 ④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是
④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 元 素 | M | F | |
| 电能 (kJ?mol-1) |
I1 | 717 | 759 |
| I2 | 1509 | 1561 | |
| I3 | 3248 | 2957 | |
| 熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
| H2S | 187 | 202 | 2.6 |
| H2C2 | 272 | 423 | 以任意比互溶 |
查看答案和解析>>
科目:高中化学 来源:2009年广东省广州市高考化学二模试卷(解析版) 题型:解答题
| 代号 | 结构简式 | 水中溶解度/g(25℃) | 熔点/℃ | 沸点/℃ |
| X |  | 0.2 | 45 | 100 |
| Y |  | 1.7 | 114 | 295 |
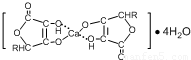
 ④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是______.这四种分子中碳原子采取sp2杂化的是______(填序号).
④HCHO四种分子均能与H2发生加成反应,加成时这些分子中发生断裂的共价键的类型是______.这四种分子中碳原子采取sp2杂化的是______(填序号).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com