
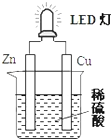
| A. | 铜片表面有气泡生成,锌片上发生氧化反应 | |
| B. | 如果将稀硫酸换成葡萄糖溶液,不能使LED灯发光 | |
| C. | 装置中存在“化学能→电能→光能”的转换 | |
| D. | 如果将铜片换成铁片,则锌片为正极 |
分析 A.铜锌原电池中,Cu作正极,Zn作负极;
B.葡萄糖是非电解质;
C.根据图中能量转化分析;
D.将铜片换成铁片,锌比铁活泼,则锌作负极,铁为正极.
解答 解:A.铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,Zn作负极,Zn失电子发生氧化反应,故A正确;
B.葡萄糖是非电解质,其溶液不导电,不能构成原电池,不能使LED灯发光,故B正确;
C.原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故C正确;
D.将铜片换成铁片,锌比铁活泼,则锌作负极,铁为正极,故D错误;
故选D.
点评 本题考查了原电池原理,明确正负极的判断方法以及能量的转化即可解答,可以从电子流向、电极上得失电子、电极上发生反应类型来判断正负极,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用加热、称重的方法鉴别Na2CO3固体和NaHCO3固体 | |
| B. | 用焰色反应鉴别NaCl固体和NaOH固体 | |
| C. | 用KSCN溶液鉴别FeCl3溶液和Fe2(SO4)3溶液 | |
| D. | 检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向卤代烃水解后的溶液中加入AaNO3溶液,根据沉淀颜色可以判断卤素原子种类 | |
| B. | 银镜反应、乙酸乙酯的水解反应、苯的硝化反应均需水浴加热 | |
| C. | 甲酸酯、葡萄糖、麦芽糖均能发生银镜反应 | |
| D. | 石油催化裂化的主要目的是提高汽油等轻质油的产量与质量;石油裂解的主要目的是为了得到更多的乙烯、丙烯等气态短链烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
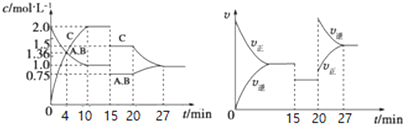
| A. | 4 min时反应第一次达到平衡 | |
| B. | 15 min时降低压强,20 min时升高温度 | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 15~20 min该反应使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2→NH3→NO→NO2→HNO3→NO | B. | Si→SiO2→H2SiO3→Na2SiO3 | ||
| C. | S→SO3→H2SO4→SO2 | D. | Al→Al2O3→Al(OH)3→NaAlO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 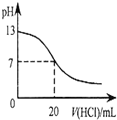 表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 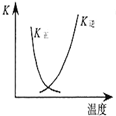 图中曲线表示反应2SO2(g)+O2(g)═2SO3(g)△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 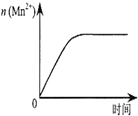 表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. |  图中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,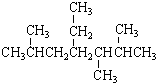 的名称为2,5,6-三甲基-4-乙基庚烷 的名称为2,5,6-三甲基-4-乙基庚烷 | |
| B. | 常压下,正戊烷、异戊烷、新戊烷的沸点依次增大 | |
| C. | 石油裂解可以得到氯乙烯,煤液化可得到焦炭、煤焦油、焦炉气等 | |
| D. | 1.0 molHC≡CCHO最多能与3.0 mol H2完全反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com