
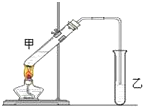
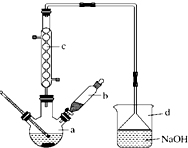
 俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:
俗话说:“陈酒老醋特别香”,其原因是酒在存储过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示装置来模拟该过程,请回答下列问题:分析 (1)酯化反应为可逆反应,且浓硫酸具有吸水性;
(2)饱和碳酸钠可吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;
(3)导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,可防止倒吸,长导管可起冷凝回流作用;
(4)乙酸乙酯与碳酸钠溶液分层;
(5)加热液体混合物,要防止液体剧烈沸腾;
(6)油状液体在上层,可知乙酸乙酯的密度比水的密度小.
解答 解:(1)酯化反应为可逆反应,且浓硫酸具有吸水性,则酯化反应中浓硫酸的作用是催化剂、吸水剂,
故答案为:催化剂;吸水剂;
(2)饱和碳酸钠溶液的主要作用是中和挥发出来的乙酸、溶解挥发出来的乙醇、减小乙酸乙酯的溶解度,有利于分层,
故答案为:中和挥发出来的乙酸、溶解挥发出来的乙醇、减小乙酸乙酯的溶解度,有利于分层;
(3)装置中通蒸气的导管只能插到饱和碳酸钠溶液的液面处,不能插入溶液中,目的是防止倒吸,长导管的作用是将反应生成的乙酸乙酯蒸汽冷凝,
故答案为:防止倒吸;将反应生成的乙酸乙酯蒸汽冷凝;
(4)要把制得的乙酸乙酯分离出来,应采用的实验操作是分液,
故答案为:分液;
(5)进行该实验时,最好从试管甲中加入几块碎瓷片,其目的是防止暴沸,
故答案为:防止暴沸;
(6)试管乙中观察到的现象是试管上层有油状液体生成,由此可见,乙酸乙酯的密度比水小,
故答案为:试管上层有油状液体生成;小.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意有机物的性质,题目难度不大.


科目:高中化学 来源: 题型:实验题
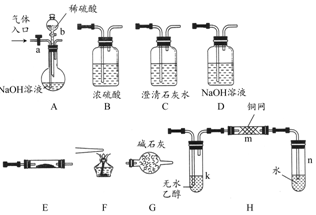 如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).
如图所示为常见气体制备、分离、干燥和性质验证的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题(仪器装置可任意选用,必要时可重复选择).查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
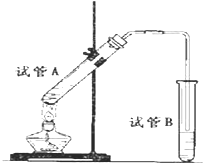 如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.
如图所示,中学化学实验室采用该装置用于制备乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
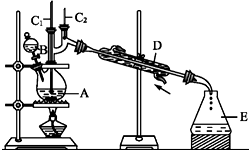
 溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:
溴苯是一种化工原料,实验室合成溴苯的装置示意图如图所示,物质的有关数据信息如表,请按下列合成步骤回答问题:| 苯 | 溴 | 溴苯 | |
| 密度/g?cm-3 | 0.88 | 3.10 | 1.50 |
| 沸点/℃ | 80 | 59 | 156 |
| 水中溶解度 | 微溶 | 微溶 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 沸点/℃ | 密度/(g•cm-3) | 水中溶解性 | |
| 正丁醇 | 117.2 | 0.810 9 | 微溶 |
| 正丁醛 | 75.7 | 0.801 7 | 微溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | CH3COONa | Na2S |
| pH | 7.5 | 9.5 | 11.8 |
| A. | 根据如,NaF的水解程度比CH3COONa的大 | |
| B. | 同体积、同pH的两种酸溶液消耗同浓度NaOH的体积:HF>CH3COOH | |
| C. | 向100mL 0.1 mol•L-1 CH3COONa溶液中通入224mL HF气体(标准状况):c(CH3COOH)+c(H+)═c(OH-)+c(F-) | |
| D. | 若将0.05 mol HC1缓慢地通入1 L 0.1 moL•L-Na2S溶液中,则溶液中离子浓度大小为:c(Cl-)>c(HS-)>c(OH-)c(S2-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2165kJ•mol-1 | |
| B. | B2H6(g)+3O2(g)═B2O3(s)+3H2O(g)△H=-2033kJ•mol-1 | |
| C. | B2H6(g)+3O2(g)═B2O3+3H2O△H=-2165kJ•mol-1 | |
| D. | B2H6(g)+O2(g)═B2O3(s)+H2O(l)△H=-2165kJ•mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com