
| A. | 聚乙烯塑料的老化是因为发生了加成反应 | |
| B. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| C. | 棉花和木材的主要成分都是纤维素,蚕丝和人造丝的主要成分都是蛋白质 | |
| D. | 在清洗地板时,84消毒液和洁厕灵(主要成分是盐酸)不能混合使用 |
分析 A.聚乙烯塑料的老化是因为发生了氧化反应;
B.水晶是二氧化硅的晶体;
C.棉花和木材的主要成分都是纤维素,蚕丝的主要成分都是蛋白;
D.盐酸和次氯酸钠反应生成氯气.
解答 解:A.聚乙烯塑料的老化是因为发生了氧化反应,没有发生加成反应,故A错误;
B.水晶的成分为二氧化硅属于氧化物,不是硅酸盐,故B错误;
C.棉花和木材的主要成分都是纤维素,蚕丝的主要成分都是蛋白,人造丝是一种丝质的人造纤维,主要成分不是蛋白质,故C错误;
D.洁厕灵(含盐酸)和84消毒液(含次氯酸钠)进行混用,会产生有毒气体氯气,故D正确.
故选D.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaH在水中显碱性 | |
| B. | NaH中氢离子电子层排布与氦原子相同 | |
| C. | NaH中氢离子半径比锂离子半径大 | |
| D. | NaH中氢离子被还原为H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
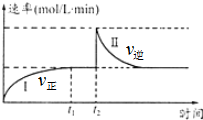 在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(
在一定恒温体积可变的密闭容器中发生如下反应:A(g)+B(g)?2C(g)△H<0.t1时刻达到平衡后,在t2时刻改变某一条件达新平衡,其反应过程如图.下列说法中错误的是(| A. | 0~t2时,v正>v逆 | |
| B. | t2时刻改变的条件可能是加催化剂 | |
| C. | Ⅰ、Ⅱ两过程达到平衡时,A的体积分数Ⅰ>Ⅱ | |
| D. | Ⅰ、Ⅱ两过程达到平衡时,平衡常数I<Ⅱ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X、Y、Z、W 元素的离子半径依次减小 | |
| B. | W 的气态氢化物的沸点一定高于Z的气态氢化物的沸点 | |
| C. | 若W 与Y的原子序数相差5,则二者形成的化合物的化学式可能为Y2W3或Y3W2 | |
| D. | W 与X形成的化合物只含离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
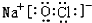
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | R原子最外层电子数为5 | B. | 单质的氧化性:甲<乙 | ||
| C. | 原子半径:R>Z | D. | HRO3与HZ计量数之比为1:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
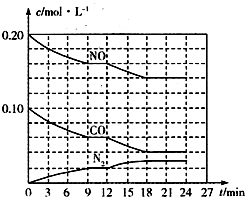 为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.
为有效控制雾霾,各地积极采取措施改善大气质量.有效控制空气中氮氧化物、碳氧化物和硫氧化物显得尤为重要.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,将铁片置于足量浓硝酸中:Fe+4H++2NO3-═Fe2++2NO2↑+2H2O | |
| B. | 向次氯酸钙溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 在溶液中FeI2与氯气3:4反应:2Fe2++6I-+4Cl2═2Fe3++3I2+8Cl- | |
| D. | 向Ba(OH)2溶液中加过量的NH4HSO4溶液:Ba2++2OH-+SO42-+H++NH4+═BaSO4↓+H2O+NH3•H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com