
目前,“低碳经济”备受关注,CO2的产生及有效开发利用成为科学家研究的重要课题。试运用所学知识,解决下列问题:
(1)已知某反应的平衡表达式为: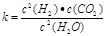 它所对应的化学反应为:__ ___
它所对应的化学反应为:__ ___
(2)—定条件下,将C(s)和H2O(g)分别加入甲、乙两个密闭容器中,发生(1)中反应:其相关数据如下表所示:
| 容器 | 容积/L | 温度/℃ | 起始量/mol | 平衡量/mol[ | 达到平衡所需时间/min | |
| C(s) | H2O(g) | H2(g) | ||||
| 甲 | 2 | T1 | 2 | 4 | 3.2 | 8 |
| 乙 | 1 | T2 | 1 | 2 | 1,2 | 3 |
 CH3OCH3(g)+ 3H2O(g)
CH3OCH3(g)+ 3H2O(g)| 投料比[n(H2)/ n(CO2)] | 500 K | 600 K | 700 K | 800 K |
| 1.5 | 45% | 33% | 20% | 12% |
| 2.0 | 60% | 43% | 28% | 15% |
| 3.0 | 83% | 62% | 37% | 22% |
(1)C(s)+2H2O(g) CO2(g)+ 2H2 (g)(2分)
CO2(g)+ 2H2 (g)(2分)
(2)①12.8 (1分,不写单位不扣分,写错单位不得分) ②C (2分)③ AD(2分)
(3)CO2(g)+3H2(g)=CH3OH(l)+H2O(l) △H=-131.9kJ/mol(2分)
(4)①<(1分),<(1分)
②CH3OCH3 -12e- +16OH-=2CO32- +11H2O(2分) 9.6(2分)
解析试题分析:(1)表达式中分子为产物,分母为反应物,因为有二氧化碳生成,故还有固体碳参加,固体不写在平衡常数表达式中;
(2)①将容器甲中的相关数据代入平衡常数表达式中,注意将物质的量转化成平衡时的浓度;②三分钟水的转化量为1.2mol,因为起始时浓度大,反应速率快,故1.5分钟水的转化量大于0.6mol,故1.5分钟时水的浓度小于1.4mol/L;(3)写出二氧化碳和氢气反应生成甲醇和水的化学方程式、甲醇和氢气燃烧热的化学方程式,根据盖斯定律得制取甲醇的反应的△H,写出让热化学方程式;(4)①温度升高,二氧化碳的转化率减小,故正反应为放热反应;因为气体系数和减小,故熵变小于零;②负极甲醚失去电子在碱性溶液中生成碳酸根离子和水,通入的甲醚失去电子总数等于铜离子得到电子总数,根据电子守恒算出析出铜的质量。
考点:化学平衡常数表达式、化学平衡的移动、盖斯定律的应用、电极反应式的书写和应用电子守恒计算等知识


科目:高中化学 来源: 题型:填空题
(9分)如图所示,把试管放入盛有25℃的饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5mL盐酸于试管中。试回答下列回答: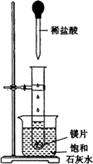
(1)实验中观察到的现象是____________________。(选填代号)
| A.试管中镁片逐渐溶解 | B.试管中产生无色气泡 |
| C.烧杯外壁变冷 | D.烧杯底部析出少量白色固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知某反应A(g)+B(g)??C(g)+D(g)过程中的能量变化如图所示,回答问题。
该反应是 (填“吸热”或“放热”)反应,该反应的ΔH= kJ/mol(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量 (填“一定高”“一定低”或“高低不一定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氨是重要的化工产品和化工原料。
(1)氨的电子式是 。
(2)已知: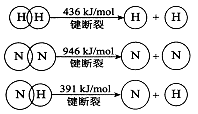
①合成氨的热化学方程式是 。
②降低温度,该反应的化学平衡常数K .(填“增大”、“减小’’或“不变”)。
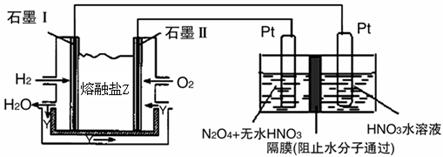
(3)有人设想以N2和H2为反应物,以溶有A的稀盐酸为电解质溶液,可制造出既能提供电能,又能固氮的新型燃料电池,装置如图l所示。
电池正极的电极反应式是 ,A是 。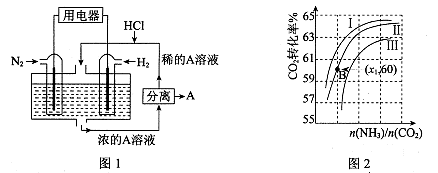
(4)用氨合成尿素的反应为2NH3(g)+CO2(g) CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比
CO(NH2)2(l)+ H2O(g)。工业生产时,原料气带有水蒸气。图2表示CO2的转化率与氨碳比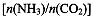 、水碳比
、水碳比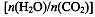 的变化关系。
的变化关系。
①曲线I、II、III对应的水碳比最大的是 。
②测得B点氨的转化率为40%,则x1 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
天然气、重油、煤都可以与水反应制得氢气。下表是某合成氨厂采用不同原料时的相对投资费用和能量消耗的数据。
| 原料 | 天然气 | 重油 | 煤 |
| 相对投资费用 | 1.0 | 1.5 | 2.0 |
| 能量消耗/J·t-1 | 28×109 | 38×109 | 48×109 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸,在工业上一般可进行连续生产。请回答下列问题:
(1)已知:N2(g)+O2(g) = 2NO(g) △H=+180.5kJ/mol
N2(g)+3H2(g) 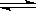 2NH3(g) △H=-92.4kJ/mol
2NH3(g) △H=-92.4kJ/mol
2H2(g)+O2(g) = 2H2O(g) △H=-483.6kJ/mol
写出氨气经催化氧化完全生成一氧化氮气体和水蒸气的热化学方程式为
。
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g) 2NH3(g)反应的影响。
2NH3(g)反应的影响。
实验结果如图所示: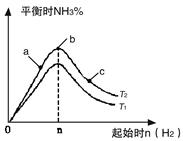
(图中T表示温度,n表示物质的量)
①图像中T2和T1的关系是:T2 T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2 的转化率最高的是(填字母)。 。
③若容器容积为1L,在起始体系中加入1mol N2 ,n=3mol反应达到平衡时H2的转化率为60%,则此 条件下(T2),反应的平衡常数K= 。保持容器体积不变,再向容器中加入1mol N2,3mol H2反应达到平衡时,氢气的转化率将
(填“增大”、“减”或“不变”)。
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注。
①一定温度下,在恒容密闭容器中N2O5可发生下列反应:
2N2O5(g) 4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
4NO2(g)+O2(g) ΔH>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 50 | 100 |
| c(N2O5)/mol·L—1 | 5.0 | 3.5 | 2.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当它们混合反应时,即产生大量氮气和水蒸气,并放出大量热。已知0.4 mol液态肼与足量液态双氧水反应,生成水蒸气和氮气,放出256.652 kJ的热量。
(1)反应的热化学方程式为 _________________________。
(2)已知H2O(l) H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
H2O(g) ΔH="+44" kJ·mol-1则16 g液态肼与液态双氧水反应生成液态水时放出的热量是 kJ。
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是
___________________________________。
(4)发射卫星可用肼为燃料,二氧化氮作氧化剂,两者反应生成氮气和水蒸气。已知:
N2(g)+2O2(g) 2NO2(g) ΔH="+67.7" kJ·mol-1
2NO2(g) ΔH="+67.7" kJ·mol-1
N2H4(g)+O2(g) N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
N2(g)+2H2O(g) ΔH="-534" kJ·mol-1
肼和二氧化氮反应的热化学方程式为 __________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
作为国家正在实施的“西气东输”工程终点站——上海将逐步改变以煤、石油为主的能源结构,这对解决城市环境污染意义重大。
(1)目前上海大部分城市居民所使用的燃料主要是管道煤气,浦东新区居民
开始使用东海天然气作为民用燃料,管道煤气的主要成分是CO、H2和少量
烃类,天然气的主要成分是CH4,它们燃烧的化学方程式为:
2CO+O2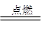 2CO2 2H2+O2
2CO2 2H2+O2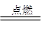 2H2O CH4+2O2
2H2O CH4+2O2 CO2+2H2O
CO2+2H2O
根据以上化学方程式判断:燃烧相同体积的管道煤气和天然气,消耗空气体积较大的是 ,因此燃烧管道煤气的灶具如需改烧天然气,灶具的改进方法是 进风口(填“增大”或“减小”),如不作改进可能产生的不良结果是 。
(2)管道煤气中含有的烃类,除甲烷外,还有少量乙烷、丙烷、丁烷等,它们的某些性质如下:
| | 乙烷 | 丙烷 | 丁烷 |
| 熔点/℃ | -183.3 | -189.7 | -138.4 |
| 沸点/℃ | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一个小烧杯里加入约20 g已研磨成粉末的氢氧化钡晶体[Ba(OH)2·8H2O],将小烧杯放在事先已滴有3~4滴水的玻璃片上,然后向烧杯内加入约10 g氯化铵晶体,并立即用玻璃棒迅速搅拌。试回答下列问题:
(1)写出反应的化学方程式:______________。
(2)实验要立即用玻璃棒迅速搅拌的原因是_________________。
(3)如果实验中没有看到“结冰”现象,可能的原因是__________________________(答出三个或三个以上原因)。
(4)如果没有看到“结冰”现象,我们还可以采取哪些方式来说明该反应吸热?__________________________________________________________________________________________(答出两种方案)。
(5)“结冰”现象说明反应是一个________(填“放出”或“吸收”)能量的反应,即断开旧化学键________(填“放出”或“吸收”)能量____________(填“>”或“<”)形成新化学键________(填“吸收”或“放出”)的能量。
(6)该反应在常温下就可以进行,说明______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com