
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 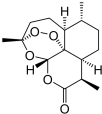 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
分析 A.有机玻璃的成分是聚甲基丙烯酸甲酯;
B.只含C、H元素的有机物是烃;
C.纯银器和空气中硫化氢发生化学腐蚀而不是电化学腐蚀;
D.维生素C具有还原性,可防止亚铁被氧化.
解答 解:A.有机玻璃的成分是聚甲基丙烯酸甲酯,是有机物,故A错误;
B.只含C、H元素的有机物是烃,该物质中除了含有C、H元素外还含有O元素,属于烃的衍生物,故B错误;
C.纯银器和空气中硫化氢发生化学腐蚀生成硫化铝而变黑,该过程不是电化学腐蚀过程,故C错误;
D.维生素C具有还原性,可防止亚铁被氧化,可在口服硫酸亚铁片时同服维生素C,可增强治疗缺铁性贫血效果,故D正确;
故选D.
点评 本题考查较综合,涉及物质成分及基本概念、金属腐蚀与防护、氧化还原反应等知识点,为高频考点,明确基本概念、基本化学反应是解本题关键,注意化学在生产生活中的应用,题目难度不大.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 过量的铜与浓硝酸反应有一氧化氮生成 | |
| B. | 白磷在空气中加热到一定温度能转化为红磷 | |
| C. | 光化学烟雾不会引起呼吸道疾病 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
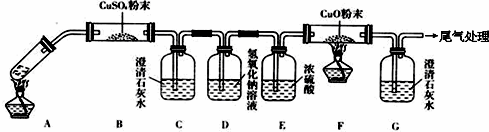
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | abcd | B. | bcd | C. | acd | D. | abc |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
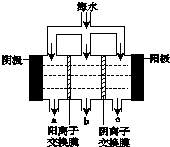 《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.
《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一.水是一种重要的自然资源,是人类赖以生存不可缺少的物质.水质优劣直接影响人体健康.海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景.人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
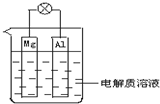 如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):
如图所示,组成一种原电池.试回答下列问题(灯泡功率合适):查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com