
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色粘稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍。则A的相对分子质量为:______。
(2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g。则A的分子式为:________。
(3)另取A9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况)。用结构简式表示A中含有的官能团:______________________。
(4)A的核磁共振氢谱如下图:则A中含有__________种氢原子。
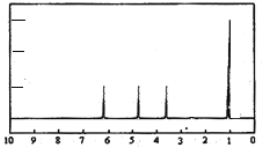
(5)综上所述,A的结构简式_______________________________。
【答案】90 C3H6O3 -COOH、-OH 4 ![]()
【解析】
(1)相同条件下,气体的相对分子质量之比等于密度之比;
(2)浓硫酸可以吸收水蒸气,碱石灰可以吸收二氧化碳气体,根据原子守恒计算分子中C、H原子数目,进而确定是否含有O元素,确定有机物的分子式;
(3)羧基可以和碳酸氢钠发生化学反应生成二氧化碳,-OH、-COOH和金属钠发生化学反应生成氢气,根据生成气体物质的量判断含有的官能团;
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子;
(5)峰面积之比等于氢原子的数目之比,结合A的分子式、含有的官能团确定A的结构简式。
(1)该有机物A的密度是相同条件下H2的45倍,所以有机物A的相对分子质量=45×2=90,故答案为:90;
(2)9.0gA的物质的量=![]() =0.1mol,浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)=
=0.1mol,浓硫酸增重5.4g,则生成水的质量是5.4g,生成n(H2O)=![]() =0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)=
=0.3mol,所含有n(H)=0.6mol,碱石灰增重13.2g,生成m(CO2)是13.2g,n(CO2)=![]() =0.3mol,所以n(C)=0.3mol,n(A)∶n(C)∶n(H)=0.1mol∶0.3mol∶0.6mol=1∶3∶6,则有机物A中碳原子个数是3,氢原子个数是6,根据相对分子质量是90,所以氧原子个数=
=0.3mol,所以n(C)=0.3mol,n(A)∶n(C)∶n(H)=0.1mol∶0.3mol∶0.6mol=1∶3∶6,则有机物A中碳原子个数是3,氢原子个数是6,根据相对分子质量是90,所以氧原子个数=![]() =3,即分子式为:C3H6O3,故答案为:C3H6O3;
=3,即分子式为:C3H6O3,故答案为:C3H6O3;
(3)9.0gA的物质的量=![]() =0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=
=0.1mol,A和碳酸氢钠反应说明A中含有羧基,生成2.24LCO2(标准状况),n(CO2)=![]() =0.1mol,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),n(H2)=
=0.1mol,所以含有一个羧基;醇羟基和羧基都可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),n(H2)=![]() =0.1mol,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2∶1,A与钠反应时,A的物质的量与氢气的物质的量之比是1∶1,则说明A中除了含有一个羧基外还含有一个羟基,故答案为:-COOH、-OH;
=0.1mol,羧基或羟基与钠反应生成氢气时,羧基或羟基的物质的量与氢气的物质的量之比为2∶1,A与钠反应时,A的物质的量与氢气的物质的量之比是1∶1,则说明A中除了含有一个羧基外还含有一个羟基,故答案为:-COOH、-OH;
(4)根据A的核磁共振氢谱图可以看出,A的核磁共振氢谱中有4个峰值,则含4种类型的等效氢原子,故答案为:4;
(5)根据A的核磁共振氢谱可以看出,A的核磁共振氢谱中有4个峰值,且氢原子的个数比是3∶1∶1∶1,所以结构简式为:![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】一定体积的酸性KMnO4溶液恰好能氧化一定质量的KHC2O4·H2C2O4·2H2O。若用0.2000 mol·L-1的NaOH溶液中和相同质量的KHC2O4·H2C2O4·2H2O,所需NaOH溶液的体积恰好为KMnO4溶液的3倍,则KMnO4溶液的浓度(mol·L-1)为( )
A.0.0176B.0.1600C.0.1200D.0.2400
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2016年8月国际期刊eLife上发表了浙江医科大学第二医院和浙江大学肿瘤研究的晁明和胡汛等人的一片论文,引发轰动。媒体以廉价的小苏打协助饿死了癌细胞予以报道。在实验室中模拟工业制取NaHCO3的实验步骤如下:
第一步:连接好装置,检验气密性,在仪器内装入药品。
第二步:先让某一装置发生反应,直到产生的气体不能再在C中溶解,再通入另一装 置中产生的气体,片刻后,C中出现固体。继续向C中通入两种气体,直到不再有固体产生。
第三步:分离C中所得的混合物,得到NaHCO3固体。
第四步:向滤液中加入适量的某固体粉末,有NH4Cl晶体析出。
(1)下图所示装置的连接顺序是:a接______;_____接________;b接________(填接口编号)
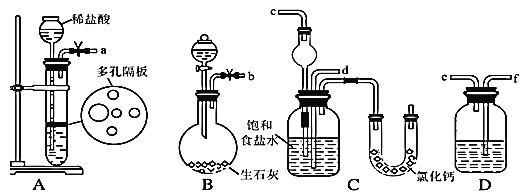
(2)检查A装置气密性的具体操作是___________。
(3)A中常选用的固体反应物为_________;D中应选用的液体为______。
(4)装有无水CaCl2的U形管的作用是 _______。
(5)第四步所得的晶体中常含有少量的NaCl和NaHCO3(约占5%~8%),请设计一个简单实验,不使用其他任何试剂,证明所得晶体大部分是NH4C1。简要写出操作和现象________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g) ![]() H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g) ![]() H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g) ![]() 2NO(g)
2NO(g) ![]() H>0
H>0
若1mol空气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的![]() H>0,简述该设想能否实现的依据 。
H>0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨甲环酸(G),别名止血环酸,是一种已被广泛使用半个世纪的止血药,它的一种合成路线如下(部分反应条件和试剂略):
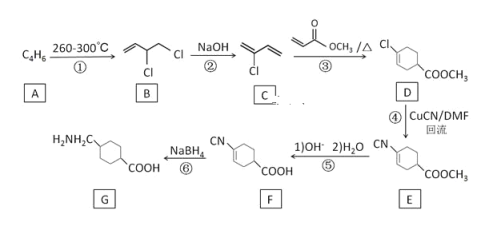
回答下列问题:
(1)A的结构简式是________。
(2)C的化学名称是__________。
(3)②的反应类型是________。
(4)E中不含N原子的官能团名称为_______。
(5)氨甲环酸(G)的分子式为________。
(6)写出满足以下条件的所有E的同分异构体的结构简式:________。a.含苯环 b.含硝基 c.核磁共振氢谱有三组峰
(7)写出以![]() 和
和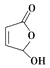 为原料,制备医药中间体
为原料,制备医药中间体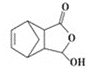 的合成路线:__(无机试剂任选)。
的合成路线:__(无机试剂任选)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA表示阿伏加德罗常数的数值,下列说法正确的是
A. 在标准状况下,11.2L HF含有的分子数目为0.5NA
B. 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子
C. 常温下,0.2 L 0.5 mol·L-1 NH4NO3溶液中含有的氮原子数小于0.2NA
D. 18g葡萄糖(C6H12O6)分子含有的羟基数目为0.6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为证实Ba(OH)2溶液和H2SO4溶液的反应是离子反应,设计了如下实验。请补充完成该实验报告。
(1)(实验原理)
溶液的导电性由溶液中离子的浓度及离子电荷数决定。观察_____,据此判断溶液中自由移动的离子浓度的变化,从而证明反应是离子反应。
(2)(实验装置)如图1所示。

(实验过程与记录)
实验步骤 | 实验现象 | 实验结论 |
连接好装置,向烧杯中加入25mL1molL﹣1的Ba(OH)2溶液和2滴酚酞溶液,逐滴滴加1molL﹣1的H2SO4溶液直至过量,边滴边振荡。 | (2)_____(填写支持实验结论的证据) | Ba(OH)2溶液和H2SO4溶液的反应是离子反应 |
(3)整个过程中混合溶液的导电能力(用电流强度Ⅰ表示)可近似地用图2中的_____(填序号)曲线表示。
(4)下列三种情况下,与上述实验中离子方程式相同的是_____。
A 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至SO42﹣恰好完全沉淀
B 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至至溶液显中性
C 向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至过量
(5)已知:PbSO4难溶于水,但可溶于醋酸氨溶液中形成无色溶液,其化学方程式为:PbSO4+2CH3COONH4=(CH3COO)2Pb+(NH4)2SO4.写出该反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】葡萄酒中抗氧化剂的残留量是以游离SO2的含量计算,我国国家标准(GB2760-2014)规定葡萄酒中SO2的残留量≤0.25g/L。某兴趣小组设计实验方案对葡萄酒中SO2进行测定。
Ⅰ.定性实验方案如下:
(1)将SO2通入水中形成SO2 ─饱和H2SO3溶液体系,此体系中存在多个含硫元素的平衡,分别用平衡方程式表示为_______________。
(2)利用SO2的漂白性检测干白葡萄酒(液体为无色)中的SO2或H2SO3。设计如下实验:

实验结论:干白葡萄酒不能使品红溶液褪色,原因为:_________________________。
Ⅱ.定量实验方案如下(部分装置和操作略):
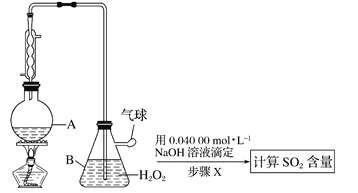
(3)仪器A的名称是________________。
(4)A中加入100.0mL葡萄酒和适量盐酸,加热使SO2全部逸出并与B中H2O2完全反应,其化学方程式为______________。
(5)除去B中过量的H2O2,然后再用NaOH标准溶液进行滴定, 除去H2O2的方法是__________。
(6)步骤X滴定至终点时,消耗NaOH溶液25.00mL,该葡萄酒中SO2的含量为__________g/L。该测定结果比实际值偏高,分析原因________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com