
 SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则图中右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )
SO2通入BaCl2溶液中并不产生沉淀,而通入另一种气体后可以产生白色沉淀.则图中右侧Y形管中放置的药品组合不符合要求的是(必要时可以加热)( )| A、Cu和浓硝酸 |
| B、大理石和稀盐酸 |
| C、CaO和浓氨水 |
| D、高锰酸钾溶液和浓盐酸 |


科目:高中化学 来源: 题型:
| 选项 | 实验 | 装置或仪器 |
| A | 分离乙酸乙酯中混有的乙酸 |  |
| B | 用已知浓度NaOH滴定未知浓度盐酸 |  |
| C | 从KI和I2的固体混合物中回收I2 |  |
| D | 配制100mL 0.100 0mol?L-1 NaOH溶液 | 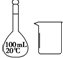 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下0.1 mol/L的下列溶液①NH4Al(SO4)2 ②NH3?H2O③NH4Cl ④CH3COONH4中,c(NH4+)由大到小的顺序是:①>③>④>② |
| B、将0.1 mol?L-1的NaHS和0.1 mol?L-1Na2S溶液等体积混合:c(S2-)+2c(OH-)=2c(H+)+c(HS-)+3c(H2S) |
| C、将0.2 mol CH3COONa晶体和0.1 mol HCl气体同时溶解于同一烧杯的水中,制得1 L溶液:c(CH3COO-)+c(OH-)=0.10 mol?L-1 |
| D、已知HClO+Na2CO3=NaClO+NaHCO3,在等物质的量浓度等体积次氯酸溶液与碳酸钠溶液混合溶液中:c(HClO)+c(H+)+c(H2CO3)═c(OH-)+c(CO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同 | ||
| B、pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | ||
| C、某溶液中由水电离出来的c(H+)和c(OH-)的乘积为1×10-24,该溶液中一定可以大量存在K+、Na+、[Al(OH)4]-、SO42- | ||
D、常温下0.1 mol?L-1HA溶液的pH>1,0.1 mol?L-1BOH溶液中
|
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| A、该反应的化学方程式:3X+2Y=2Z |
| B、若两容器均达到平衡时,两容器的体积V(I)<V(II),则容器II达到平衡所需时间小于t0 |
| C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 |
| D、若达平衡后对容器II升高温度使其体积增大,说明Z发生的反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| A、①② | B、②③ |
| C、②③④ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜. 请按要求回答相关问题:
如图所示,某同学设计了一个燃料电池并探究氯碱工业原理的相关问题,其中乙装置中X为阳离子交换膜. 请按要求回答相关问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com