
| 元素编号 | 元素性质或原子结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z | 最外层电子数比次外层电子数少5个电子 |
| W | 灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色 |
 ,化合物WXY的电子式
,化合物WXY的电子式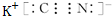 .
.分析 元素X的一种同位素可测定文物年代,原子的最外层电子数是次外层电子数的2倍,则X为C元素;常温下单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素原子最外层电子数比次外层电子数少5个电子,原子序数小于20,Z原子有3个电子层,最外层电子数为3,故Z为Al;灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色,则W为K元素,据此答题.
解答 解:元素X的一种同位素可测定文物年代,原子的最外层电子数是次外层电子数的2倍,则X为C元素;常温下单质为双原子分子,其氢化物水溶液呈碱性,则Y为N元素;Z元素原子最外层电子数比次外层电子数少5个电子,原子序数小于20,Z原子有3个电子层,最外层电子数为3,故Z为Al;灼烧其化合物时通过蓝色钴玻璃片观察火焰为紫色,则W为K元素,
(1)碳元素的一种同位素可测定文物年代:这种同位素的符号是146C,Z为Al元素,质子数为13,离子核外有2个电子层,各层电子数为2、8,其原子结构示意图为: ,化合物WXY为KCN,其电子式为
,化合物WXY为KCN,其电子式为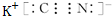 ,
,
故答案为:146C; ;
;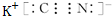 ;
;
(2)N元素与氢元素形成一种离子为NH4+,则检验溶液中存在该离子的方法是:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+,
故答案为:向溶液(或待测液)中加入NaOH溶液后加热,能产生使湿润的红色石蕊试纸变蓝的气体,说明溶液中存在NH4+,反之,不存在NH4+;
(3)Z元素最高价氧化物对应的水化物为Al(OH)3,与NaOH溶液反应生成偏铝酸钠与水,反应离子方程式:Al(OH)3+OH-═AlO2-+2H2O,
故答案为:Al(OH)3+OH-═AlO2-+2H2O;
(4)C、N同周期,随原子序数增大非金属性增强,故N元素非金属性较强,
a.单质的状态属于物理性质,不能比较非金属性强弱,故a错误;
b.Y(N元素)的最高价氧化物水化物的酸性比X(碳)的最高价氧化物水化物的酸性强,说明Y(N)的非金属性更强,故b正确;
c.X(碳)与Y(N)形成的化合物中X元素呈正价态,说明Y(N)元素对键合电子吸引能力更强,Y(N)的非金属性更强,故c正确,
故答案为:N;bc.
点评 本题考查结构性质位置关系应用,难度不大,推断元素是解题关键,侧重对基础知识的巩固.


科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热为 890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3 kJ/mol | |
| B. | 500℃、30MPa 下,将 0.5mol N2(g)和 1.5molH2(g)置于密闭容器中充分反应生成 NH3(g)放热 19.3 kJ,其热化学方程式为: N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ/mol | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ/mol,则 H2SO4 和 Ca(OH)2 反应的中和热△H=2×(-57.3)kJ/mol | |
| D. | 在 101 kPa 时,2gH2完全燃烧生成液态水,放出 285.8kJ 热量,氢气燃烧的热化学方程式表示为 2H2(g)+O2(g)=2H2O(l)△H=-571.6 kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
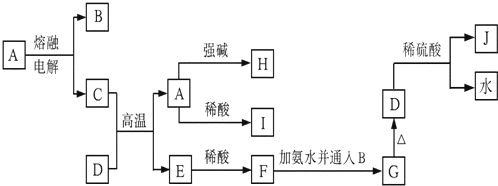
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通CO的一极是电池的正极 | |
| B. | 该电池工作过程中需不断补充CO和O2,CO2可循环利用 | |
| C. | 负极反应式为:O2+2CO2+4e-→2CO32- | |
| D. | 正极反应式为:2CO+2CO32-→4CO2+4e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极反应为:Zn-2e-+2OH--Zn(OH)2 | |
| B. | 放电时正极发生氧化反应 | |
| C. | 放电时每转移2mol电子,反应的锌的质量是65g | |
| D. | 放电时化学能转化为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ⅦA族元素是同周期中非金属性最强的元素 | |
| B. | 原子序数为15的元素的最高化合价为+3 | |
| C. | 最外层电子数是2的元素一定位于元素周期表的第ⅡA族 | |
| D. | 第二周期ⅣA族元素的原子核电荷数和中子数一定为6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径是第ⅡA族中最大的 | B. | 遇冷水能剧烈反应 | ||
| C. | 位于第七周期 | D. | Ra(OH)2是两性氢氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气通入氢硫酸 | B. | H2S缓慢通入饱和氯水 | ||
| C. | H2S缓慢通入亚硫酸 | D. | SO2缓慢通入氢硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com