
| ��ѧ��ʵ | ���ƽ��� | |
| A | ±�ص��ʵķе㣺F2��Cl2��Br2��I2 | �⻯��е㣺HF��HCl��HBr��HI |
| B | �õ������MgCl2���Ƶý���þ | �õ������NaClҲ������ȡ������ |
| C | ��CO2ͨ��Ba��NO3��2��Һ���������� | ��SO2ͨ��Ba��NO3��2��Һ��Ҳ�������� |
| D | Al��S����ʱֱ�ӻ�������Al2S3 | Fe��S����ʱҲ��ֱ�ӻ������� Fe2S3 |
| A�� | A | B�� | B | C�� | C | D�� | D |
���� A��HF���Ӽ���������������е���±��������ߣ�
B��Na��þ��Ϊ���ý�����ͨ����ⷨ���Ի�ý������ʣ�
C��������������ˮ��Һ�����ԣ�����������������������ܹ��������������������ᣬ���������ᱵ��Ӧ�������ᱵ������
D������S���ʼ��ȷ�Ӧ��������������
��� �⣺A������HF���Ӽ�������������HF�ķе�ϴ���ȷ�ķе�ߵ�Ϊ��HCl��HBr��HI��HF����A����
B������Na��Mg�Ļ����Խ�ǿ����ҵ���õ������MgCl2���Ƶý���þ���õ������NaClҲ������ȡ�����ƣ���B��ȷ��
C����CO2ͨ��Ba��NO3��2��Һ�У����߲�������Ӧ�����������ɣ����ǽ�SO2ͨ��Ba��NO3��2��Һ�л��������ᱵ��������C����
D��Al��S����ʱֱ�ӻ�������Al2S3���������ʵ������Խ�����Fe��S����ʱҲ��ֱ�ӻ������ɵ���FeS��������Fe2S3����D����
��ѡB��
���� ���⿼���˻�ѧʵ�鷽�������ۣ���Ŀ�Ѷ��еȣ��漰���������ұ����Ԫ�ػ���������Ӧ�õ�֪ʶ��CΪ�״��㣬ע��������������ᱵ�ܹ��������ᱵ����������������ѧ���ķ������������Ӧ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ʵ �� �� ʵ | �� �� | |
| �� | SO2ʹ���Ը��������Һ��ɫ | ��֤��SO2��Ư���� |
| �� | Ũ����ɳ�ȥ��ƿ�ڲ�����MnO2��ϡ����ɳ�ȥ�Թ��ڱڵ���������ĥ�ڲ���ƿ���ܱ���NaOH��Һ | ��������������ԭ��Ӧ |
| �� | ȡ����Na2SO3��Ʒ����Ba��NO3��2��Һ������ɫ�������μ�ϡ���ᣬ�������ܽ� | ֤��Na2SO3���������� |
| �� | ij��Һֻ��һ�����ʣ�����ϡ���������ʹ����ʯ��ˮ����ǵ���ɫ��ζ���壬�����Һ�еμ�BaCl2��Һ���а�ɫ�������� | ȷ������Һ�д���CO32- |
| �� | ij��ɫ��Һ�м���Ũ����������Һ�����ȣ�������������ʹʪ����ɫʯ����ֽ��� | ����Һһ����NH4+ |
| A�� | �٢ڢܢ� | B�� | �٢ڢۢ� | C�� | �٢ۢܢ� | D�� | ȫ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | MnO4��Mn2- | B�� | HCl��Cl2 | C�� | Fe��Fe3- | D�� | KClO3��O2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�22.4LH2O���еķ�����Ϊ NA | |
| B�� | ���³�ѹ�£�1.06g Na2CO3���е�Na+������Ϊ0.02 NA | |
| C�� | ���ʵ���Ũ��Ϊ1mol/L��MgCl2��Һ�У�����Cl-����Ϊ2NA | |
| D�� | ͨ��״���£�NA ��CO2����ռ�е����Ϊ22.4L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ѧ��Ӧ���ʣ�4v����O2��=5v����NO�� | |
| B�� | NH3��O2��NO��H2O�ķ��Ӹ�������4��5��4��6 | |
| C�� | ��λʱ��������4 mol NO��ͬʱ����6 mol H2O | |
| D�� | ��Ӧ�������NH3������������ٸı� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
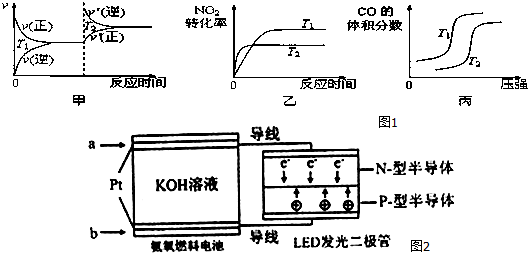
ʱ��/min Ũ��/��mol/L�� | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.0 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
| CO2 | 0 | 0.21 | 0.30 | 0.30 | 0.36 | 0.36 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
| ��ѧʽ | H2��g�� | CO��g�� | CH3OH��l�� |
| ��ȼ���ȣ�25�棩 ��H/kJ•mol-1 | -285.8 | -283.0 | -726.5 |
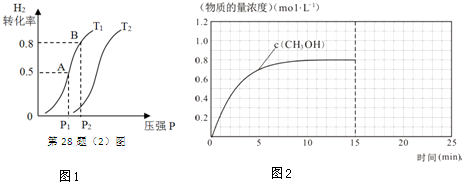
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com