
| A. | ①②③ | B. | ①③④ | C. | ②③④ | D. | ①②④ |
分析 相似相溶原理是指由于极性分子间的电性作用,使得极性分子组成的溶质易溶于极性分子组成的溶剂,难溶于非极性分子组成的溶剂;非极性分子组成的溶质易溶于非极性分子组成的溶剂,难溶于极性分子组成的溶剂,据此解答.
解答 解:①氯化氢为极性分子,易溶于极性溶剂水,与相似相溶原理有关,故正确;
②碘为非极性分子,易溶于非极性分子,难溶于极性溶剂水,与相似相溶原理有关,故正确;
③氯气非极性分子,易溶于非极性分子,能溶于水,是因为与水反应生成氯化氢和次氯酸,与相似相溶原理物关,故错误;
④NH3属于极性分子易溶于极性溶剂水,与相似相溶原理有关,故正确;
故选:B.
点评 本题考查了相似相溶原理的应用,明确相似相溶的规律,准确判断分子的极性是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | “钴酞菁”分子既不能透过滤纸,又不能透过半透膜,混有氯化钠的“钴酞菁”可用渗析的方法净化 | |
| B. | “钴酞菁”与水所形成的分散系具有丁达尔效应 | |
| C. | 此项工作可以用来改变分子的某些物理性质 | |
| D. | 此项工作可广泛应用于光电器件、生物技术等方面 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(2)(3) | B. | (1)(3)(4) | C. | (2)(4) | D. | (1)(4) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 其溶液中由水电离出的c(H+)的大小关系是 ①=②>③>④>⑤ | |
| B. | 其溶液中由水电离出的(H+)的大小关系是 ④>③>①=⑤>② | |
| C. | 上述溶液中能能促进水的电离是②>①=>⑤>③ | |
| D. | 上述溶液中能促进水的电离是只有④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
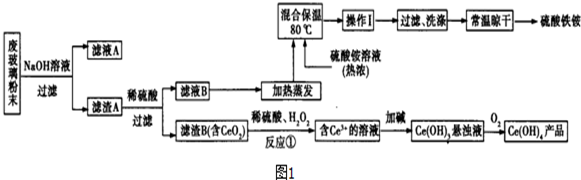
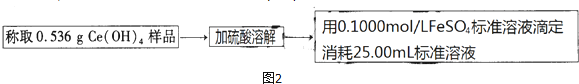
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
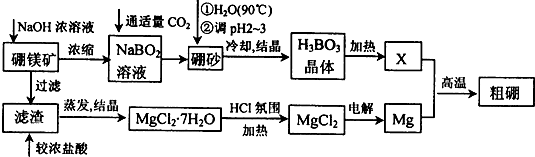
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度、溶解度、物质 | (NH4)2SO4 | FeSO4•7H2SO4 | 硫酸亚铁铵晶体 |
| 10 | 73.0 | 40.0 | 18.1 |
| 20 | 75.4 | 48.0 | 21.1 |
| 30 | 78.0 | 60.0 | 24.5 |
| 40 | 81.0 | 73.3 | 27.9 |
| 50 | 84.5 | - | 31.3 |
| 70 | 91.9 | - | 38.5 |
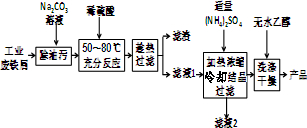
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+、Na+、NO${\;}_{3}^{-}$、CO${\;}_{3}^{2-}$ | B. | Na+、Cl-、NH${\;}_{4}^{+}$、SO${\;}_{4}^{2-}$ | ||
| C. | K+、Cl-、HCO${\;}_{3}^{-}$、H+ | D. | Ca2+、Na+、Fe3+、NO${\;}_{3}^{-}$ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com