
| A. | 液氨汽化吸热,故液氨常做食品工厂的制冷剂 | |
| B. | 硅酸钠的水溶液俗称水玻璃,可用作木材防腐剂和阻燃剂 | |
| C. | 水晶项链和餐桌上的瓷盘都是硅酸盐制品 | |
| D. | 可用冷的浓硝酸迅速除去铝壶底的水垢 |
科目:高中化学 来源: 题型:解答题
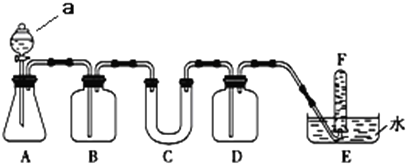
| 仪器 | 加入试剂 | 加入该试剂的目的 |
| B | 饱和NaHCO3溶液 | |
| C | Na2O2 | 与CO2及水蒸气反应,产生O2 |
| D | . |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C和14C互为同位素 | |
| B. | 乙醇与二甲醚(CH3-O-CH3)互为同分异构体 | |
| C. | H2O与D2O互为同位素 | |
| D. | 红磷与白磷互为同素异形体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li、Be、B原子最外层电子数逐渐增多 | |
| B. | P、S、Cl最高正价依次升高 | |
| C. | N、O、F得电子能力逐渐减弱 | |
| D. | Li、Na、K、Rb的金属性依次增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Na+、Cl-、CO32- | B. | Fe2+、NO3-、Na+、Cl- | ||
| C. | NH4+、K+、AlO2-、SiO32- | D. | Cu2+、NH4+、SO42+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨水是一种的常用的化学试剂.
氨水是一种的常用的化学试剂.| 实验步骤 | 实验操作 | 预期现象及结论 (步骤1只写现象) |
| 1 | 在A、B两支洁净的试管中各加入1mL 2%的AgNO3溶液,然后边振荡试管边逐滴滴入2%稀氨水,至沉淀恰好溶解,此时制得pH均约为8的银氨溶液. | 先生成白色沉淀 后沉淀溶解 |
| 2 | 往A、B试管加入3滴乙醛,然后在A试管中加1滴NaOH溶液;振荡后将两支试管放在热水浴中温热. | 若A试管比B试管出现的银镜时间短、光亮,则则溶液pH大 反应速率快; 若A试管比B试管出现的银镜时间长,则则溶液pH大 反应速率慢. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA | |
| B. | 1mol CH3+(碳正离子)中含有电子数为10NA | |
| C. | 室温下,21.0g乙烯和丁烯的混合气体中含有的碳原子数目为1.5NA | |
| D. | 1mol乙烷分子含有8NA个共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com