
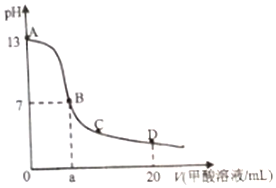
 在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )
在15mL0.lmol•L-1KOH溶液中逐滴加入0.2mol•L-1甲酸溶液,溶液pH和加入甲酸(弱酸)的体积关系曲线如图所示,下列关系正确的是( )| A. | 在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 | |
| B. | 在A、B间任意一点,c(HCOO-)>c(K+)>c(OH-)>c(H+) | |
| C. | 在D点:c(HCOO-)+c(HCOOH)>2c(K+) | |
| D. | B→C段:水的电离程度先增大后减小 |
分析 A.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,溶液显示碱性,欲显中性,甲酸应该稍过量,则有a>7.5;
B.开始时c(OH-)>c(HCOO-),所以A、B之间不一定满足c(HCOO-)>c(OH-);
C.点甲酸过量,所加入甲酸的物质的量大于KOH的物质的量的2倍,根据物料守恒进行判断;
D.B点是甲酸钾和甲酸的混合溶液,在C点甲酸过量,溶液呈酸性,抑制水的电离,酸浓度增大水电离程度减小;
解答 解:A.当恰好中和时消耗0.2mol/L甲酸溶液7.5mL,反应生成甲酸钠溶液,溶液显示碱性,若溶液为中性,则c(OH-)=c(H+),根据电荷守恒c(K+)=c(HCOO-),由于溶液中存在部分甲酸,则应该满足a>7.5,故A错误;
B.在A、B间任意一点,因为开始时c(OH-)>c(HCOO-),即有可能存在:c(K+)>c(OH-)>c(HCOO-)>c(H+),故B错误;
C.D点甲酸过量,所加入甲酸的物质的量为:0.02L×0.2mol/L═0.004mol,KOH的物质的量为:0.015L×0.1mol/L=0.0015mol,根据物料守恒,则反应后溶液中一定满足:c(HCOO-)+c(HCOOH)>2c(K+),故C正确;
D.B点是甲酸钾和甲酸的混合溶液,在C点甲酸过量,溶液呈酸性,抑制水的电离,酸浓度增大水电离程度减小,故D错误;
故选C.
点评 本题考查酸碱混合溶液PH的判断与计算,这是一道以中和滴定为背景,以图象呈现为方式的离子浓度大小比较题,题目难度中等,注意从电解质的强弱以及酸碱混合反应的角度分析,注意分析曲线的变化特点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 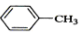 +Cl2$\stackrel{光照}{→}$ +Cl2$\stackrel{光照}{→}$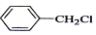 +HCl +HCl | |
| B. | 2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O | |
| C. | ClCH2CH=CH2+NaOH→HOCH2CH=CH2+NaCl | |
| D. | 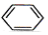 +HONO2$\stackrel{浓硫酸}{→}$ +HONO2$\stackrel{浓硫酸}{→}$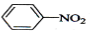 +H2O +H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl溶液 | |
| B. | 用氢氧化钠鉴别MgCl2溶液、AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用澄清石灰水鉴别SO2、CO2气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
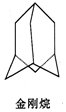 金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.
金刚烷结构如图,其结构非常对称,1H-NMR谱中只有两个信号.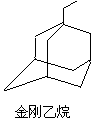 $→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$
$→_{I}^{Cl_{2}}$M$→_{II}^{NH_{3}}$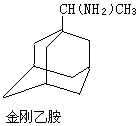
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗0.8molNaClO3时,转移的电子数为0.8NA | |
| B. | H2O不是氧化产物,也不是还原产物,CO2是还原产物,ClO2是氧化产物 | |
| C. | 氧化剂和还原剂的物质的量之比为4:1 | |
| D. | 每生成1molCO2需转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | TI3+>Fe3+>Ag+ | B. | Fe3+>Ag+>TI3+ | C. | Tl+>Ag+>Fe2+ | D. | TI3+>Ag+>Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此时,v (A):v (B):v (C):v (D)=4:3:2:1 | |
| B. | 该反应体系中气体的平均相对分子质量不变不可作为平衡标志 | |
| C. | 充入N2使压强增大可加快反应速率 | |
| D. | C的平均反应速率为:0.15mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验目的或结论 |
| A | 将某溶液中加入盐酸,有气体生成,气体能使澄清石灰水变浑浊 | 该溶液中有CO32- |
| B | 向某溶液中加入氯化钡溶液生成白色沉淀,再加稀硝酸,白色沉淀不消失 | 该原溶液一定含有SO42- |
| C | 下层液体从分液漏斗下端管口放出后,关闭活塞,换一个接收容器,再将上层液体从下端管口放出 | 取出分液漏斗中的上层液体 |
| D | 向某溶液中加入NaOH溶液并加热,有气体产生,用湿润的红色石蕊试纸,试纸显蓝色 | 说明该溶液中一定含有NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 83% | B. | 17% | C. | 50% | D. | 60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com