
| A | |||||||||||||||||
| D | E | F | |||||||||||||||
| B | C | G | H | I | J |
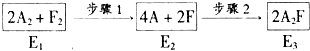
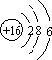 故答案为:
故答案为: ;
;

科目:高中化学 来源: 题型:
| A、用石墨电极电解Ca(NO3)2溶液,当转移电子数为0.2NA时,阴极析出4g金属 |
| B、0.1mol 24Mg32S晶体中所含中子总数为2.8NA |
| C、常温下含有NA个NO2、N2O4分子的混合气体,温度降至标准状况,其体积约为22.4L |
| D、在熔融状态下,1mol NaHSO4完全电离出的阳离子数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
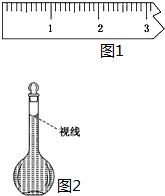 实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.
实验室需要配制0.50mol/L NaCl溶液480mL.按下列操作步骤填上适当的文字,以使整个操作完整.查看答案和解析>>
科目:高中化学 来源: 题型:
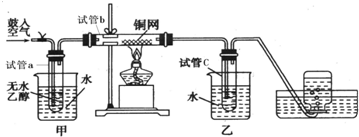
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )
如图是元素周期表前四周期的一部分,下列对相关元素的叙述正确的是( )| A、X元素的原子有二个电子层,处于周期表的第14纵行 |
| B、X的气态氢化物与Y的最高价氧化物的水化物能反应生成盐 |
| C、Z的原子序数为31,单质常温下为液体 |
| D、气态氢化物水溶液的酸性X<Z<Y |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铊是易导电的银白色金属 |
| B、Tl(OH)3是两性氢氧化物 |
| C、能生成+3价离子化合物 |
| D、Tl3+的氧化能力比Al3+强 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 信息 |
| X | K层电子数是L层电子数的2倍 |
| Y | 一种核素在考古时常用来鉴定一些文物的年代 |
| Z | 所处的周期序数与族序数相等 |
| W | 最高价氧化物对应的水化物酸性最强 |
| A、W的阴离子半径大于Z的阳离子半径 |
| B、Y的氢化物比W的氢化物稳定 |
| C、Z的最高价氧化物对应的水化物不能够溶于Y的最高价氧化物对应的水化物 |
| D、X在氧气中加热反应生成X2O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
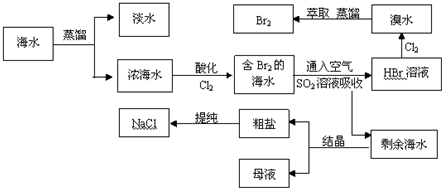
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com