
【题目】已知A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期.A位于周期表的s区,其原子中电子层数和未成对电子数相同;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同;D原子的核外成对电子数与未成对电子数的比值为3:2.同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面.A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂.E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同.
请回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)下列叙述正确的是(填字母).
a.M易溶于水,是因为M是极性分子;N不溶于水,是因为N是非极性分子
b.M和二氧化碳分子中的中心原子均采用sp2杂化
c.N分子中含有6个σ键和3个π键
d.BD2晶体的熔、沸点都比二氧化硅晶体的低
(2)金属E的晶胞是面心立方结构(如图),则E晶体的1个晶胞中含E原子数为: , 距离E原子最近且等距离的E的原子数为: , 该晶胞中原子的空间利用率为 .
(3)X和Y分别是B和C与氢的化合物,这两种化合物都含有18电子.X和Y的化学式分别是、 . 两者沸点的关系为XY(“>”或“<”),原因是 .
【答案】
(1)d
(2)4;12;74%
(3)C2H6;N2H4;<;X分子间作用力小于Y
【解析】解:A、B、C、D、E五种元素的原子序数依次递增,A、B、C、D位于前三周期,A位于周期表的s区,其原子中电子层数和未成对电子数相同,则A为H元素;B的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同,则B为为C元素;
D原子的核外成对电子数与未成对电子数的比值为3:2,则D为O元素,所以C为N元素;
同时含有A、B、D三种元素的化合物M是一种居室污染气体,其分子中所有的原子共平面,则M为HCHO;
A、B两种元素组成的原子个数比为1:1的化合物N是常见的有机溶剂,则N为苯;
E有“生物金属”之称,E4+离子和氩原子的核外电子排布相同,则E原子核外电子数=18+4=22,为Ti元素;(1)a.正负电荷中心不重合的为极性分子,重合的为非极性分子,M是甲醛、N是苯,二者都是非极性分子,因为甲醛和水能形成氢键而易溶于水,苯和水不能形成氢键,所以苯不易溶于水,故a错误;
b.M分子中C原子价层电子对个数是3、二氧化碳分子中C原子价层电子对个数是2,根据价层电子对互斥理论判断原子杂化方式分别为sp2、sp,故b错误;
c.苯分子中含有12个σ键和1个大π键,苯分子中不存在碳碳双键和碳碳单键,是介于单键和双键之间的特殊键,故c错误;
d.分子晶体熔沸点低于原子晶体,二氧化硅是原子晶体、二氧化碳是分子晶体,所以二氧化碳的熔沸点比二氧化硅的低,故d正确;
故选d;(2)Ti原子个数=6× ![]() +8×
+8× ![]() =4,距离E原子最近且等距离的E的原子数=3×8÷2=12,
=4,距离E原子最近且等距离的E的原子数=3×8÷2=12,
设原子半径为rcm,面的对角线上的三个原子紧靠在一起,所以晶胞面上对角线长为4rcm,则晶胞棱长= ![]() cm=2
cm=2 ![]() rcm,晶胞体积=(2
rcm,晶胞体积=(2 ![]() r)3cm3 , 晶胞中原子所占体积=4×
r)3cm3 , 晶胞中原子所占体积=4× ![]() r3cm3=
r3cm3= ![]() r3cm3 , 该晶胞中原子的空间利用率
r3cm3 , 该晶胞中原子的空间利用率 ![]() ×100%=74%,
×100%=74%,
所以答案是:4;12;74%(3)X和Y分别是B和C与氢的化合物,这两种化合物都含有18电子,则X为C2H6、Y为N2H4;不含氢键的分子晶体熔沸点与分子间作用力成正比,分子间作用力与相对分子质量成正比,二者都是分子晶体且不含氢键,乙烷相对分子质量小于肼,所以乙烷熔沸点低于肼,
所以答案是:C2H6;N2H4;<.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】将l00ml 1mol/L 的NaHCO3溶液等分为两份,其中一份加入少许冰醋酸,另外一份加入少许Ba(OH)2固体,忽略溶液体积变化。两份溶液中c(CO32-)的变化分别是
A.减小、减小B.减小、增大C.增大、增大D.增大、减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的氢气在一定条件下完全燃烧生成气态水,放出热量值为Q1,等量的H2在同样条件下完全燃烧生成液态水,放出热量值为Q2,则Q1与Q2的关系为
A. Q1>Q2B. Q1=Q2C. Q1<Q2D. 无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下物质相互转化,A是生活中用量最大的金属。
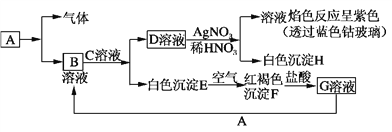
试回答:
(1)写出C的化学式________,H的化学式________。
(2)写出由E转变成F的化学方程式____________________________________。
(3)检验G溶液中的金属阳离子的方法是________________________________。
(4)写出A在一定条件下与水反应的化学方程式_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核磁共振(NMR)技术已广泛应用于复杂分子结构的测定和医学诊断等高科技领域.已知只有质子数或中子数为奇数的原子核才有NMR现象.试判断下列哪组原子均可产生NMR现象( )
A.18O、31P、119Sn
B.27Al、19F、12C
C.7N、15P、33As、51Sb、83Bi
D.只有一个电子层的原子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com