
 某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.
某课外活动小组同学用如图装置进行实验,一段时间后在C电极表面有铜析出,试回答下列问题.分析 (1)在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极;
(2)根据电解析出的物质,从而判断加入何种物质使溶液恢复到原来的浓度;
(3)整个装置中电子的得失数相等,根据E的电极反应求出产生的C(OH-),最终得到溶液的PH值;
(4)根据原电池原理,正极发生的是化合价降低得电子的反应.
解答 解:在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,则C、E、G为阴极,D、F、H为阳极,
(1)在C电极表面有铜析出,则C为阴极,可知A为负极,B为正极,故答案为:正极;
(2)甲中发生的反应:2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2+2H2SO4,由方程式知,电解出的物质有Cu和O2,所以加入CuO或CuCO3可以使溶液恢复到原来的浓度,但Cu(OH)2或碱式碳酸铜会使溶液变稀,不能恢复到原来的浓度,故答案为:CuO或CuCO3;
(3)n(Cu)=3.2g÷64g/mol=0.05mol,
丙中:Cu2++2e-=Cu
0.1mol 0.05mol
整个装置中电子的得失数相等,故乙中转移电子数也为0.1mol,
乙中的电解反应式为:2NaCl+2H2O$\frac{\underline{\;通电\;}}{\;}$2NaOH+H2↑+Cl2↑,
阴极电极方程式为:2H2O+2e-=2OH-+H2↑,
0.1mol 0.1mol
故c(OH-)=0.1 mol/L,c(H+)=1×10-13 mol/L,pH=13,
故答案为:13;
(4)原电池正极发生的是化合价降低得电子的反应,根据方程式可知是O2得电子,另外,由于H2SO4存在,所以发生的O2酸性条件下的电极反应:4H++O2+4e-═2H2O,故答案为:4H++O2+4e-═2H2O.
点评 本题主要考查点解池的原理,为高频考点,侧重学生的分析、计算能力的考查,解题的关键是掌握电解池中离子的放电情况,即阳离子都是在阴极得电子放电,另外,抓住整个装置中电子得失相等,进行电解池中有关量的计算或判断,如:产物的量、溶液的PH、化学式等.


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:选择题
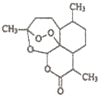 中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )
中国药学家屠呦呦因最早发现并提纯抗疟新药青蒿素而获得2015年度诺贝尔生理学或医学奖.已知青蒿素可从与青蒿同属的黄花蒿中提取,其结构如图所示,下列有关青蒿素说法不正确的是( )| A. | 化学式为C15H20O5 | |
| B. | 能与NaOH溶液发生反应 | |
| C. | 与H2O2含有相似结构,具有杀菌作用 | |
| D. | 提取方法主要是低温萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
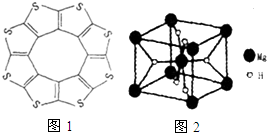 氢能被视为21世纪最具发展潜力的清洁能源.
氢能被视为21世纪最具发展潜力的清洁能源.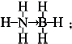 ;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).
;与氨硼烷互为等电子体的有机小分子是CH3CH3(写结构简式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:3 | B. | 1:4 | C. | 1:5 | D. | 1:6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ③④⑤ | C. | ②③⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.
氢气是一种清洁能源,氢气的制取是氢能源利用领域的研究热点;氢气也是重要的化工原料.| 时间/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com