
| A. | 氨水与氯化铝溶液反应产生氢氧化铝沉淀 | |
| B. | 用氨水做导电实验,灯泡很暗 | |
| C. | 0.1mol/L的氨水的pH<13 | |
| D. | 氯化铵溶液的pH<7 |
分析 要证明NH3•H2O为弱电解质,可证明存在电离平衡、不能完全电离或从对应的强酸盐溶液呈酸性的角度,以此解答该题.
解答 解:A.强碱和弱碱都和氯化铝溶液反应生成沉淀,不能说明氨水是弱电解质,故A错误;
B.溶液导电性和电解质强弱无必然的联系,溶液的导电性与离子的浓度有关,弱电解质的浓度大时导电实验中灯泡也很亮,没有对比实验,无法说明一水合氨是弱电解质,故B错误;
C.常温下0.1mol/L氨水溶液若为强碱溶液中氢氧根离子浓度为0.1mol/L,溶液PH=13,pH<13说明NH3.H2O部分电离,为弱电解质,故C正确;
D.NH4Cl溶液显酸性说明氯化铵是强酸弱碱盐,则证明NH3.H2O是弱电解质,故D正确;
故选CD.
点评 本题考查弱电解质的判断,明确弱电解质的性质是解答本题的关键,常用的方法是利用电离的不完全性、测定盐溶液的pH、做对比实验等来判断弱电解质,题目难度不大.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:推断题
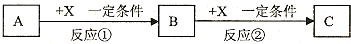
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 空气(混合物)、C2H5OH(醇)、H2SO4(离子化合物)、液氨(电解质) | |
| B. | CO2(非电解质)、NH4Cl(铵盐)、HNO3(含氧酸)、NaOH(强电解质) | |
| C. | HCl(共价化合物)、CH3COOH(羧酸)、Na2O2(碱性氧化物)、CH3I(卤代烃) | |
| D. | NO2(酸性氧化物)、CH3CHO(有机物)、CO(有机物)、CH3COOCH3(酯) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | x=0.4a,2Fe2++Cl2═2Fe3++2Cl- | |
| B. | x=0.6a,2Br-+Cl2═Br2+2Cl- | |
| C. | x=2a,2Fe2++2Br-+2Cl2═Br2+2Fe3++4Cl- | |
| D. | x=1.5a,2Fe2++4Br-+3Cl2═2Br2+2Fe3++6Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1mol H2O的体积为22.4L | |
| B. | 1mol•L-1的氯化钠溶液是指此溶液中含有1mol NaCl | |
| C. | 从1L 1mol•L-1的NaCl溶液中取出100mL溶液,其物质的量浓度变为0.1mol•L-1 | |
| D. | 以g•mol-1为单位时,在数值上摩尔质量与相对分子质量或相对原子质量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若锌粉有剩余,则不溶物中一定有铜,可能有铁 | |
| B. | 若锌粉有剩余,则溶液中的金属阳离子只有Zn2+ | |
| C. | 若锌粉无剩余,且溶液中尚存有Cu2+,则一定有Fe2+ | |
| D. | 若锌粉无剩余,且溶液中无Cu2+,则一定有Zn2+,一定无Fe3+,但不能确定有无Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
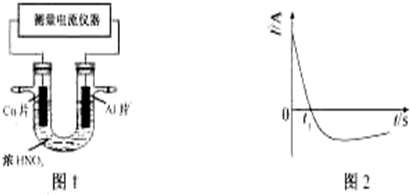
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 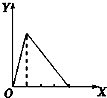 向NaOH溶液中逐滴加入AlCl3溶液至过量且边滴边振荡 | |
| B. | 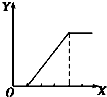 向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡 | |
| C. | 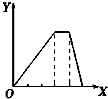 向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液直至过量 | |
| D. | 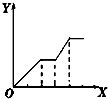 向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com