
 .
. .
.分析 现有1-20号元素,A原子M层上有6个,则A是S元素;D元素最高正价是+7价,属于第VIIA族元素,且原子序数小于20,F元素没有正化合价,所以D是Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,氯化钙能作干燥剂,所以B是Ca元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,则C是N元素,以此解答该题.
解答 解:现有1-20号元素,A原子M层上有6个,则A是S元素;D元素最高正价是+7价,属于第VIIA族元素,且原子序数小于20,F元素没有正化合价,所以D是Cl元素;B的离子与D的离子具有相同电子层结构,且可以相互组合形成干燥剂,氯化钙能作干燥剂,所以B是Ca元素;常温下C单质为双原子分子,其氢化物水溶液呈碱性,则C是N元素,
(1)B的离子与D的离子相互组合形成的干燥剂CaCl2,氯化钙为离子化合物,用电子式表示下列物质的形成过程为 ,
,
故答案为:CaCl2; ;
;
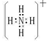
(2)元素C与氢元素形成带一个单位正电荷的离子,该离子是NH4+离子,其电子式为: ,
,
故答案为: ;
;
(3)同一周期元素,元素的非金属性随着原子序数的增大而增大,所以氯元素非金属性大于硫,
a.单质的状态,属于物理性质,不能比较非金属性强弱,故a错误;
b.Cl元素非金属性比S强,故HCl比硫化氢稳定,故b正确;
c.一定条件下氯气能从硫化氢水溶液中置换出S单质,说明氯元素非金属性比S强,故c正确,
d.氢化物溶液酸性强弱不能说明元素非金属性强弱,若非金属性F>Cl,但酸性HF<HCl,故d错误,
故答案为:Cl;bc.
点评 本题考查元素化合物知识,为高频考点,侧重于学生的分析能力的考查,正确推断元素是解本题关键,结合物质的性质来分析解答,难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| B. | 麦芽糖及其水解产物均能发生银镜反应 | |
| C. | 用溴水即可鉴别苯酚溶液、2,4-己二烯和甲苯 | |
| D. | 将甘氨酸和丙氨酸混合后缩合最多可形成4种二肽 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
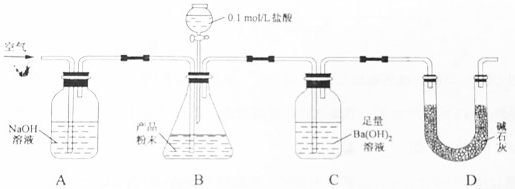
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
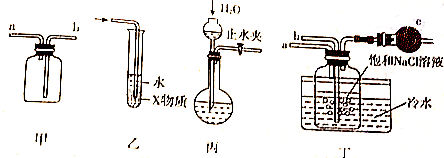
| A. | 装置甲可用于收集H2、NH3、CO2、Cl2等气体 | |
| B. | 装置乙中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| C. | 装置丙可以用于检验装置气密性 | |
| D. | 装置丁中b通入CO2,然后a通入NH3,用于实验室模拟制备NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{2}^{3}$He的最外层电子数为2,具有较强的金属性 | |
| B. | ${\;}_{2}^{3}$He位于周期表第二周期第ⅡA族 | |
| C. | 其原子核中质子数为2、中子数为1 | |
| D. | 核聚变是通过化学反应而释放出的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 待测液 | 消耗标准盐酸(0.1000mol/L)的体积 | |
| ① | 20.00mL NaOH溶液 | V1 mL |
| ② | 20.00mL NaOH溶液+10.00mL水 | V2 mL |
| ③ | 敞口隔夜放置的20.00mL NaOH溶液 | V3 mL |
| A. | c=0.1000×$\frac{{V}_{1}+{V}_{2}+{V}_{3}}{3×20.00}$ | B. | c=0.1000×$\frac{{V}_{1}+{V}_{2}}{2×20.00}$ | ||
| C. | c=0.1000×$\frac{{V}_{1}+{V}_{3}}{2×20.00}$ | D. | c=$\frac{0.1000{V}_{1}}{20.00}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
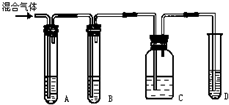
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饮用矿泉水瓶的主要成分是聚氯乙烯 | |
| B. | 淀粉和纤维素均为天然高分子化合物 | |
| C. | 凡含有食品添加剂的食物均不可食用 | |
| D. | 大米煮成粥后,淀粉就变成了葡萄糖 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com