
分析 NO2和O2混合气体与反应可能的反应式有:4NO2+O2+2H2O=4HNO3,3NO2+H2O=2HNO3+NO,根据反应的方程式有讨论的方法计算.
解答 解:如氧气过量,则剩余5ml无色气体为氧气,设参加反应的氧气的体积为x,则有:
4NO2+O2+2H2O=4HNO3
4x x
4x+x=30ml-5ml=25ml,
x=5ml,所以氧气的体积为:5ml+5ml=10ml;
如NO2过量,则剩余5ml无色气体为NO,设氧气的体积为y,
4NO2+O2+2H2O=4HNO3
4y y
3NO2+H2O=2HNO3+NO
3 1
(30ml-y-4y) 5
y=3ml,
答:原混合气体中O2体积为10ml或3ml.
点评 本题考查混合物的计算,题目难度中等,注意气体的过量判断,结合方程式计算.


科目:高中化学 来源: 题型:选择题
| A. | 酒精灯在桌上歪倒失火后,立即用湿布盖灭 | |
| B. | 灭火,也用黄沙扑灭 | |
| C. | 如果苯酚溶液沾到皮肤上,应立即用酒精洗 | |
| D. | 不慎将酸溅到眼中,应立即用干布擦去 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 己烷有4种同分异构体,一定条件下能够发生取代反应 | |
| B. | 在一定条件下,苯与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| C. | 油脂皂化反应属于取代反应 | |
| D. | 聚合物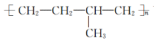 可由单体CH3CH═CH2和CH2═CH2加聚制得 可由单体CH3CH═CH2和CH2═CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 通入HCl气体之前:c(S2-)>c(HS-)>c(OH-)>c(H+) | |
| B. | pH=7的溶液中:c(Cl-)═c(HS-)+2c(H2S) | |
| C. | c(HS-)=c(S2-)的碱性溶液中:c(Cl-)+c(HS-)>0.100 mol•L-1+c(H2S) | |
| D. | c(Cl-)=0.100 mol•L-1的溶液中:c(OH-)-c(H+)=c(H2S)-c(S2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
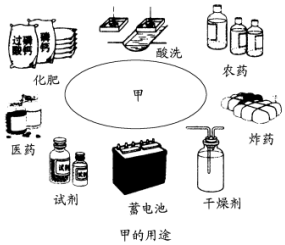 a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如下图所示.a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种.化合物甲、乙、丙、丁、戊之间也能相互反应.已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物.若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)
a、b、c是原子序数依次增大的三种常见短周期元素.由a、b、c三元素组成的化合物甲的用途如下图所示.a、b、c三元素之间两两化合可生成化合物乙、丙、丁、戊4种.化合物甲、乙、丙、丁、戊之间也能相互反应.已知乙、戊分别是由a、b两元素按原子个数1:1和2:1组成的化合物.若a、b、c三元素形成的单质(仍用a、b、c表示)和由它们组成的化合物之间的反应关系如下(未配平)查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com