
| 熔点℃ | 沸点℃ | 密度 (g/cm3) | |
| Na | 97.8 | 882.9 | 0.97 |
| K | 63.7 | 774 | 0.86 |
| NaCl | 801 | 1413 | 2.165 |
| KCl | 770 | 1500 | 1.984 |
分析 (1)KCl+Na?NaCl+K+Q (Q<0)该反应是可逆反应,且使K成蒸汽从反应混合物中分离出来,减小K蒸气的浓度平衡向正反应方向移动;
(2)由表格数据可知,K的沸点低,为774℃;反应时保证Na不能转化为气体;
(3)为了提高原料的转化率,可使平衡正向移动,吸热反应,减少生成物的浓度可使平衡正向移动;
(4)从能源、副产物对环境的影响以及操作简易性考虑解答;
(5)当反应温度升高到900℃时,Na、K均为气体,结合K为生成物浓度幂之积与反应物浓度幂之积的比解答.
解答 解:(1)工业上制取金属钾的化学原理是化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾),在常压下金属钾转为气态从反应混合物中分离,
故答案为:化学平衡移动原理(勒夏特列原理/钾蒸汽逸出使生成物浓度减小,平衡向正反应方向移动,可不断得到金属钾);
(2)由表格数据可知,钾的沸点为774℃,所以金属钾转为气态最低温度约为774℃,反应时保证Na不能转化为气体,所以反应的最高温度应低于882.9℃,
故答案为:774℃;882.9℃;
(3)KCl+Na?NaCl+K+Q (Q<0),该反应正反应为吸热反应,所以在制取金属钾的过程中,为了提高原料的转化率可采取的措施是适当的升高温度或移去钾蒸气,
故答案为:适当的升高温度或移去钾蒸气;
(4)电解熔融氯化钾生成钾、氯气,氯气有毒,废气会污染环境,且电解需消耗大量电能,操作不及此法,
故答案为:生产工艺无污染,操作简便;
(5)当反应温度升高到900℃时,只有Na、K为气体,化学平衡常数为生成物浓度系数次幂的乘积与反应物浓度系数次幂乘积的比值,则K=$\frac{c(K)}{c(Na)}$,
故答案为:$\frac{c(K)}{c(Na)}$.
点评 本题考查化学平衡常数K的意义及平衡移动,为高频考点,把握K与反应的关系、状态与表格中温度的关系为解答的关键,侧重分析与应用能力的考查,注意平衡移动原理的应用,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 向碳酸钠溶液中加入过量醋酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 向偏铝酸钠溶掖中通入过量二氧化碳;CO2+2H2O+AlO2-═Al(OH)3↓+HCO3- | |
| C. | 向莫尔盐[(NH4)2Fe(SO4)2•6H2O]溶液中加入过量氧氧化钠溶液:NH4++Fe2++3OH-═NH3•H2O+Fe(OH)2↓ | |
| D. | 向双氧水中加入酸性高锰酸钾溶液:5H2O2+2MnO4-═2Mn2++5O2↑+6OH-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
 |  |  |  |
| 从海水中获得精制食盐 | 用液氨制冷 | 用高粱、小麦酿酒 | 用铝制容器蒸、煮腌制的咸菜 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肥皂水、矿泉水及食醋三种溶液的pH依次减小 | |
| B. | 高铁车厢采用的铝合金材料强度大、质量轻,不与氧气反应 | |
| C. | 食品袋中放入盛有硅胶和铁粉的透气小袋,是为了防止食物受潮、氧化变质 | |
| D. | 采用“静电除尘”、“汽车尾气催化净化”等方法可减少“雾霾”的发生 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水分子是含极性键的极性分子 | |
| B. | 水的电离方程式为:H2O?2H++O2- | |
| C. | 重水(D2O)分子中,各原子质量数之和是质子数之和的两倍 | |
| D. | 相同质量的水具有的内能:固体<液体<气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
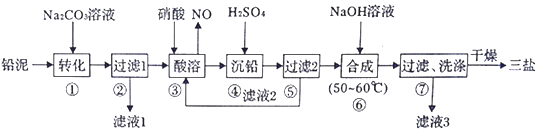
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
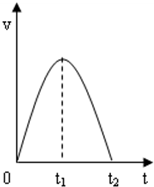 (1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.
(1)将粉末形状大小相同的铁和铝分别与等浓度的稀盐酸反应产生气泡的速率铝>铁(填“<、>、=”).Al与盐酸反应的离子方程式是2Al+6H+=2Al3++3H2↑.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
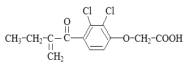 .下列有关利尿酸的说法中正确的是( )
.下列有关利尿酸的说法中正确的是( )| A. | 分子式是C13H14O4Cl2 | |
| B. | 1mol利尿酸最多能与5mol H2发生加成反应 | |
| C. | 一定条件下能发生加聚、缩聚反应 | |
| D. | 分子内处于同一平面内的原子不超过10个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com