
| A. | CSO的电子式: | |
| B. | 甲烷分子的球棍模型: | |
| C. | 2-戊烯的结构简式CH3CH2CHCHCH3 | |
| D. | HCO3-的水解方程式为:HCO3-+H2O?CO32-+H3O+ |
分析 A.类比二氧化碳的电子式进行判断;
B. 为甲烷的比例模型,不是球棍模型;
为甲烷的比例模型,不是球棍模型;
C.碳碳双键为官能团,不能省略;
D.碳酸氢根水解生成碳酸和氢氧根离子.
解答 解:A.CSO中碳原子分别与氧原子和硫原子生成了两对共用电子对,其电子式: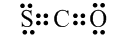 ,故A正确;
,故A正确;
B.甲烷为正四面体结构,分子中含有4个碳氢键,甲烷正确的球棍模型为: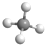 ,故B错误;
,故B错误;
C.2-戊烯的结构简式CH3CH2CH=CHCH3,故C错误;
D.HCO3-的水解方程式为:HCO3-+H2O?H2CO3+OH-,故D错误;
故选:A.
点评 本题考查了常见化学用语的表示方法,题目难度中等,涉及比例模型与球棍模型、结构简式、水解方程式的书写,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.


科目:高中化学 来源: 题型:解答题
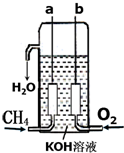 氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.
氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制.常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等.已知甲烷燃料电池的负极有碳酸根离子生成,请写出如图所构成的甲烷燃料电池中:a极的电极反应式:CH4+10OH--8e-=CO32-+7H2O,b极的电极反应式:O2+2H2O+4e-=4OH-,若将KOH溶液换为稀H2SO4,则a极的电极反应式:CH4+2H2O-8e-=CO2+8H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯与液溴在FeBr3催化下生成溴苯 | |
| B. | 乙醇在铜做催化剂的条件下,被空气中的氧气氧化成乙醛 | |
| C. | 乙烯使溴水褪色 | |
| D. | 乙酸与乙醇反应生成乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | ①液体分层,下层呈无色 | |
| B. | ②洗涤沉淀时,向漏斗中加适量水,搅拌并滤干 | |
| C. | ③分离CCl4和水 | |
| D. | ④除去氯气中的氯化氢 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | KHC2O4溶液呈弱碱性 | |
| B. | B点时:c(K+)>c(HC2O4-)>c(C2O42-)>c(H+)>c(OH-) | |
| C. | C点时:c(K+)<c(HC2O4- )+2c(C2O42-)+c(H2C2O4) | |
| D. | D点时:c(H+)+c(HC2O4-)+c(H2C2O4)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


| 0min | 5min | 10min | |
| CO | 0.1 | 0.05 | |
| H2 | 0.2 | 0.2 | |
| CH3OH | 0 | 0.04 | 0.05 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com