
【题目】下列关于热化学反应的描述中正确的是( )
A.HCl和 NaOH 反应的中和热 H=-57.3kJ·mol-1,则H2SO4 和 Ba(OH)2反应的中和热ΔH=2×(-57.3)kJ·mol-1
B.CO(g)的燃烧热是 283.0kJ·mol-1 则 2CO2(g)=2CO(g)+O2(g)反应的ΔH=+(2×283.0 )kJ·mol-1
C.反应物的总能量低于生成物的总能量时,反应一定不能自发进行
D.一定的温度和一定的压强下,将 0.5molN2 和1.5molH2 置于密闭容器中充分反应,放热19.3kJ,热化学方程式为 N2+3H2![]() 2NH3 ΔH=-38.6kJ·mol-1
2NH3 ΔH=-38.6kJ·mol-1
【答案】B
【解析】
A. 中和热是酸碱发生中和反应产生1mol水时放出的热量,与反应产生水的物质的量多少无关,所以H2SO4和Ba(OH)2反应的中和热ΔH=-57.3kJ/mol,A错误;
B. 燃烧热是1mol可燃物完全燃烧产生稳定的氧化物时放出的热量,CO(g)的燃烧热是 283.0kJ·mol-1则2molCO燃烧放出热量是(2×283.0 )kJ,由于反应物、生成物的能量相同,所以则 2CO2(g) =2CO(g)+O2(g)反应的ΔH=+(2×283.0 )kJ·mol-1 ,B正确;
C. 根据体系的自由能公式△G=△H-T△S<0,反应可以自发进行,反应物的总能量低于生成物的总能量时,△H>0,若△S>0,在高温下△G<0,反应也能自发进行,C错误;
D. N2与H2合成氨气的反应是可逆反应,反应物不能完全转化为生成物,且物质的存在状态也影响物质含有的能量,所以该热化学方程式书写不合理,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】(1)决定化学反应速率的主要因素是参加反应的物质的________,影响化学反应速率的外因有_______________________(至少填2个);
(2)H2C2O4与KMnO4反应时,它转化为CO2和H2O。实验现象________________
(3)氢氧化钡晶体Ba(OH)2·8H2O与氯化铵反应方程式_________________。
(4)Na2S2O3与稀H2SO4反应离子方程式_______________________。
(5)将向含有KI和H2SO4的混合溶液中加入淀粉溶液,放置一段时间实验现象。________
(6)在H2O2溶液中加入少量MnO2实验现象____________
(7)当1 g氨气完全分解为氮气、氢气时,吸收2.72 kJ的热量,则热化学方程式_______________
(8)由金红石(TiO2)制取单质Ti,涉及的步骤为:TiO2→TiCl4+Mg→Ti。已知:
①C(s)+O2(g)=CO2(g) ΔH1=-393.5 kJ/mol
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566 kJ/mol
③TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH3=+141 kJ/mol
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒氧化还原液流电池是一种新型绿色的二次电池。其工作原理如图所示。下列叙述正确的是
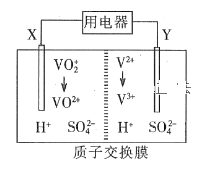
A.放电时,电子由Y极流出,经质子交换膜到X极
B.放电过程中,电解质溶液pH降低
C.充电时,X极反应式为:VO2++H2O -e- = VO2++2H+
D.放电时,每转移1 mol电子理论上有2 mol H+由交换膜右侧向左侧迁移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硅胶在干燥时因加有氯化钴(![]() )会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成
)会有颜色的变化,随吸湿量的增加由蓝色逐渐转变成浅红色,使用非常方便。某学习小组设计实验制备氯化钴,并查阅到以下资料:钴与铁相似,常见化合价为+2、+3,可溶于稀盐酸(因反应极慢,需用硝酸作催化剂才可顺利进行)。钴在纯氧中加热至300℃以上生成CoO(熔点为1 935℃),400~900℃生成![]() 。请回答下列问题:
。请回答下列问题:
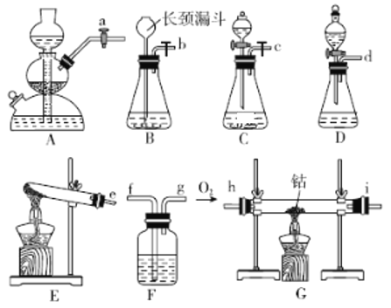
(1)实验①~④是制备氧气的试剂组合,请从A~E中选择最恰当装置符号填入表中。
实验 编号 | ① | ② | ③ | ④ |
试剂 | H2O2 溶液 | H2O2 溶液 | KMnO4 固体 | H2O2溶液 |
催化剂 | MnO2粉末 | FeCl3溶液 | 以Al2O3为载体,混有MnO2的块状物 | |
装置 | ____ | ____ | ______ | ______ |
(2)第一小组负责制备无水CoO,若选用装置C作为氧气的发生装置,则制备CoO完整装置的接口连接顺序为___________,装置C发生反应的化学方程式为_______;
(3)![]() 与
与![]() 类似,可以看作氧化钴(CoO)与氧化高钴(
类似,可以看作氧化钴(CoO)与氧化高钴(![]() )形成的化合物,写出
)形成的化合物,写出![]() 与盐酸反应的化学方程式:________________。
与盐酸反应的化学方程式:________________。
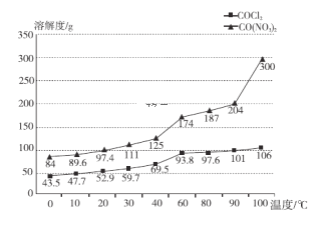
(4)第二小组同学提出另外的方案:用一定质量的钴粉与稀盐酸反应,滴入几滴稀硝酸,将得到的溶液倒入蒸发皿中,加热蒸发浓缩,38~40℃冷却结晶,趁热过滤,得到晶体。根据如图溶解度随温度变化,曲线解释能得到氯化钴晶体的原因:__________。
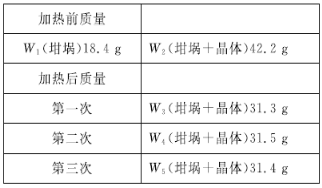
(5)为了确定晶体的化学式,小组同学把晶体洗涤、干燥、称量得到23.8 g固体,用坩埚加热至质量不再变化,数据如表所示,则该晶体的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在着下列平衡:NH3·H2O![]() NH
NH![]() +OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
+OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体 ④水 ⑤加热⑥加入少量MgSO4固体
A.①②③⑤B.③⑥C.③D.③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列可以证明2HI(g)![]() H2(g)+I2(g)已达平衡状态的是( )
H2(g)+I2(g)已达平衡状态的是( )
①单位时间内生成nmolH2的同时生成nmolHI
②一个H—H键断裂的同时有两个H—I键断裂
③温度和体积一定时,混合气体密度不再变化
④v(H2)=v(I2)=0.5v(HI)
⑤c(HI):c(H2):c(I2)=2:1:1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧温度和压强一定时,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
A. ②③④⑤⑥B. ②⑥⑦⑧⑨
C. ①②⑥⑧D. ②⑥⑨
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为我国圆明园兽首铜像—兔首和鼠首,看上去仍熠熠生辉。下列对其原因的分析最可能的是( )

A.它们表面的铜绿已用酸性溶液洗去B.利用电镀原理在其表面镀了一层耐腐蚀的黄金
C.铜的活动性很弱,与空气成分不反应D.它们是含一定比例金、银、锡、锌的铜合金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol
C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列生产或实验事实引出的结论不正确的是( )
选项 | 事实 | 结论 |
A | 其他条件相同, | 当其他条件不变时,升高反应温度,化学反应速率加快 |
B | 工业制硫酸过程中,在 | 增大气液接触面积,使 |
C | 在2L密闭容器中发生反应:
| 反应速率减慢 |
D | A、B两支试管中分别加入等体积5%的 | 当其他条件不变时,催化剂可以改变化学反应速率 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com