
| ���� | ������Ŀ | �������ݣ�mg/mL�� |
| 1 | ͭ���Ӻ��� | 4.224 |
| 2 | 4.225 | |
| 3 | 4.223 | |
| 4 | 2.005 |

���� ��1������ͭ���ã����û���ͭ��
��2����ˮ�д��ڵ���������ͭ���Ӳ���Ӧ��
��3���ٵ�4�����ݲ�������Ӧ������ƽ��ֵΪ4.224mg/mL�����n=$\frac{m}{M}$=cV���㣻
�ڽ��Ksp[Cu��OH��2]=2.2��10-20=c��Cu2+����c2��OH-�����㣻
��4��������Һ�õ����壬�ɾ�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ�����
������������ԭ��Ӧ��ͭ���ӵõ�������ͭ����Ϸ�ˮ��ͭ���ӵĺ������㣮
��� �⣺��1������ͭ���ã����û���ͭ����Ӧ�����ӷ���ʽΪFe+Cu2+=Fe2++Cu���ʴ�Ϊ��Fe+Cu2+=Fe2++Cu��
��2����ˮ�д��ڵ���������ͭ���Ӳ���Ӧ��C��D���ϣ��ʴ�Ϊ��C��D��
��3���ٵ�4�����ݲ�������Ӧ������ƽ��ֵΪ4.224mg/mL=4.224g/L��c=$\frac{\frac{4.224g}{64g/mol}}{L}$=0.066mool/L���ʴ�Ϊ��0.066mool/L��
��Ksp[Cu��OH��2]=2.2��10-20=c��Cu2+����c2��OH-������c��OH-��=$\sqrt{\frac{2.2��1{0}^{-20}}{0.066}}$mol/L=5.8��10-10mol/L��pH=9.2���ʴ�Ϊ��9.2��
��4��������Һ�õ����壬�ɾ�������Ũ������ȴ�ᾧ�����ˡ�ϴ�ӡ�����Ȳ������ʴ�Ϊ����ȴ�ᾧ��
������������ԭ��Ӧ��ͭ���ӵõ�������ͭ���缫����ʽΪCu2++2e-=Cu����ˮ��ͭ���Ӻ���ƽ��ֵΪ4.224mg/mL=4.224g/L������5L�ó��ŷŵĺ�ͭ��ˮ�������Ͽ��Եõ�ͭ4.224g/L��5L=21.12g��
�ʴ�Ϊ��Cu2++2e-=Cu��21.12g��
���� ���⿼���Ϊ�ۺϣ��漰��ˮ�Ĵ��������ܵ���ʵ��ܽ�ƽ���Լ����֪ʶ��������ѧ���ķ��������������Ŀ��飬ע��������ʵ����ʡ����ԭ����֪ʶ���Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ھƾ���ɵ�� | B�� | �� | ||
| C�� | Fe��OH��3���� | D�� | ���лҳ������Ŀ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ˮ��笠����Ӻ�����������Һ��������Ũ����� | |
| B�� | �¶��½�10�棬����Һ��pH������ | |
| C�� | ��ˮ������������Һ��Ũ����� | |
| D�� | �ֱ����Ũ�ȵ����ᷴӦ����ˮ������������������������������������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� |  | B�� |  | C�� |  | D�� |  |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
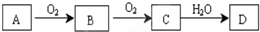
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
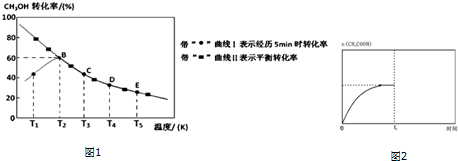
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com