
【题目】Ⅰ、(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,该金属互化物属于__________(填 “晶体”或“非晶体”),可通过__________方法鉴别。
(2)基态Ni2+的核外电子排布式为__________;配合物Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂。固态Ni(CO)4属于__________晶体;Ni2+和Fe2+的半径分别为69pm和78pm,则熔点NiO__________FeO(填“<”或“>”)。
Ⅱ、判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强。如下表所示
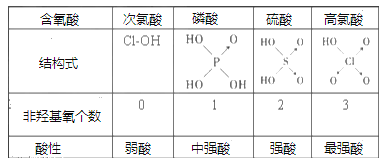
(1)亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3只有弱酸性。由此可推出亚磷酸的结构式为___________。从分子结构角度,简述二者酸性强弱原因_____________________。
(2)亚磷酸与过量的氢氧化钠溶液反应的化学方程式为:________________。
【答案】晶体 X-射线衍射 [Ar]3d8 分子 > 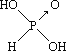 亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强 H3PO3+2NaOH=Na2HPO3+2H2O
亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强 H3PO3+2NaOH=Na2HPO3+2H2O
【解析】
根据晶体结构与性质、核外电子排布、化学键等知识分析解答;根据含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,据此确定亚磷酸(H3PO3)分子的结构式;
Ⅰ.(1)某种金属互化物具有自范性,原子在三维空间里呈周期性有序排列,说明该互化物属于晶体,可通过X-射线衍射实验进行鉴别;
故答案为:晶体;X-射线衍射实验;
(2) Ni元素原子核外电子数为28,核外电子排布式为1s22s22p63s23p63d84s2,失去4s能级2个电子形成Ni2+,所以Ni2+离子核外电子排布为:1s22s22p63s23p63d8或[Ar]3d8,Ni(CO)4常温下为液态,易溶于CCl4、苯等有机溶剂,固态Ni(CO)4属于分子晶体;Ni2+和Fe2+的离子所带电荷相同,Ni2+离子半径较小,NiO中离子键更强,NiO晶体的熔点更高;
故答案为:1s22s22p63s23p63d8或[Ar]3d8,分子,>;
Ⅱ. (1)含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强,亚磷酸是中强酸,所以亚磷酸的结构式为: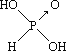 ,亚砷酸既有弱酸性又有弱碱性,亚砷酸的结构是为:
,亚砷酸既有弱酸性又有弱碱性,亚砷酸的结构是为:![]() ,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强,故亚磷酸酸性强于亚砷酸;
,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强,故亚磷酸酸性强于亚砷酸;
故答案为: ,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强;
,亚磷酸非羟基氧数目为1,亚砷酸没有非羟基氧,非羟基氧数目越多,中心原子正电性越强,酸性越强;
(2) 酸和碱反应生成盐和水,亚磷酸中含有2个羟基,属于二元酸,亚磷酸和氢氧化钠的反应方程式为:H3PO3+2NaOH=Na2HPO3+2H2O;
故答案为:H3PO3+2NaOH=Na2HPO3+2H2O。


科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A.实验中需2.00mol·L-1的NaCl溶液950mL,配制时应称取的质量是117.0g
B.标准状况下,11.2LHCl气体溶于水配成1L溶液,其浓度为0.5mol/L
C.将4g氢氧化钠溶于1L水中,所形成溶液浓度为0.1mol·L-1
D.200mLFe2(SO4)3溶液中含Fe3+56g,则溶液中SO42-的物质的量浓度为7.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有研究表明,内源性H2S作为气体信号分子家族新成员,在抗炎、舒张血管等方面具有重要的生理作用,而笼状COS(羰基硫)分子可作为H2S的新型供体(释放剂)。试回答下列有关问题
(1)COS的分子结构与CO2相似,COS的结构式为______。
(2)已知:①COS(g)+H2(g)H2S(g)+CO(g)△H1=-15kJmol-1,②COS(g)+H2(g)H2S(g)+CO2(g)△H2=-36kJmol-1,③CO(g)+H2O(g)H2(g)+CO2(g)△H3,则△H=______。
(3)COS可由CO和H2S在一定条件下反应制得。在恒容的密闭容器中发生反应并达到平衡:CO(g)+H2S(g)COS(g)+H2(g),数据如表所示、据此填空
实验 | 温度/℃ | 起始时 | 平衡时 | |||
n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | x |
3 | 400 | 20.0 | 20.0 | 0 | 0 | 16.0 |
①该反应为______(选填“吸热反应”或“放热反应”)。
②实验2达到平衡时,x______7.0(选填“>”、“<”或“=”)
③实验3达到平衡时,CO的转化率α=______
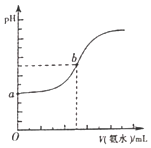
(4)已知常温下,H2S和NH3H2O的电离常数分别为向pH=a的氢硫酸中滴加等浓度的氨水,加入氨水的体积(V)与溶液pH的关系如图所示:
酸/碱 | 电离常数 | |
H2S | Ka1=1.0×10-7 | Ka2=7.0×10-15 |
NH3H2O | Kb=1.0×10-5 | |
①若c(H2S)为0.1mol/L,则a=______
②若b点溶液pH=7,则b点溶液中所有离子浓度大小关系是______。
(5)将H2S通入装有固体FeCl2的真空密闭烧瓶内,恒温至300℃,反应达到平衡时,烧瓶中固体只有FeCl2和FeSx(x并非整数),另有H2S、HCl和H2三种气体,其分压依次为0.30P0、0.80P0和0.04P0(P0表示标准大气压)。当化学方程式中FeCl2的计量数为1时,该反应的气体压强平衡常数记为Kp。计算:
①x=______(保留两位有效数字)。
②Kp=______(数字用指数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下图的说法不正确的是( )
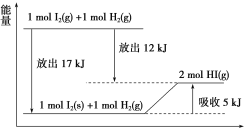
A.1 mol I2(s)与1 mol H2(g)化合生成2 mol HI(g)时,需要吸收5 kJ的能量
B.2 mol HI(g)分解生成1 mol I2(g)与1 mol H2(g)时,需要吸收12 kJ的能量
C.1 mol I2(s)变为1 mol I2(g)时需要吸收17 kJ的能量
D.I2(g)与H2(g)生成2HI(g)的反应是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组为了探究BrO3-+5Br-+6H+![]() 3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
3Br2+3H2O反应速率(v)与反应物浓度的关系,在20℃进行实验,所得的数据如下表:
实验编号 离子浓度 | ① | ② | ③ | ④ | ⑤ |
c(H+)/mol·L-1 | 0.008 | 0.008 | 0.004 | 0.008 | 0.004 |
c(BrO3-)/mol·L-1 | 0.001 | 0.001 | 0.001 | 0.002 | 0.002 |
c(Br-)/mol·L-1 | 0.10 | 0.20 | 0.20 | 0.10 | 0.40 |
v/mol·L-1·s-1 | 2.4×10-8 | 4.8×0-8 | 1.2×10-8 | 4.8×10-8 | v1 |
下列结论正确的是
A. 反应物BrO3-、Br-、H+的浓度对该反应速率的影响程度完全相同
B. 实验②、④,探究的是c(BrO3-)对反应速率的影响
C. 若该反应速率方程为v=kca(BrO3-)cb(Br-)cc(H+)(k为常数),则c=1
D. 实验⑤中,v1=4.8×10-8
查看答案和解析>>
科目:高中化学 来源: 题型:
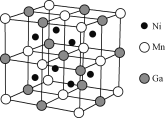
【题目】镍的单质、合金及其化合物用途非常广泛。
(1)Ni2+基态核外电子排布式为________。
(2)胶状镍可催化CH2=CHC≡N加氢生成CH3CH2C≡N。CH2=CHC≡N分子中σ键与π键的数目比n(σ)∶n(π)=________;CH3CH2C≡N分子中碳原子轨道的杂化类型为________。
(3)[Ni(N2H4)2](N3)2是一种富氮含能材料。配体N2H4能与水混溶,除因为它们都是极性分子外,还因为______________________;[Ni(N2H4)2]2+中含四个配位键,不考虑空间构型,[Ni(N2H4)2]2+的结构可用示意图表示为______________________。
(4)一种新型的功能材料的晶胞结构如下图所示,它的化学式可表示为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置能达到实验目的的是
A.除去淀粉溶液中的NaCl 
B.比较NaHCO3和Na2CO3的热稳定性
C.制备Fe(OH)2 
D.测定过氧化钠的纯度
查看答案和解析>>
科目:高中化学 来源: 题型:
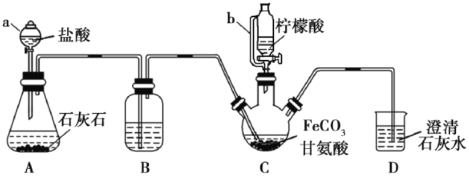
【题目】甘氨酸亚铁[(NH2CH2COO)2Fe]是一种补铁强化剂。实验室利用FeCO3与甘氨酸(NH2CH2COOH)制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4gFeCO3和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是_______________。
(2)装置B中盛有的试剂是:____________;装置D的作用是________________。
(3)向FeSO4溶液中加入NH4HCO3溶液可制得FeCO3,该反应的离子方程式为____________________________。
(4)过程I加入柠檬酸促进FeCO3溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
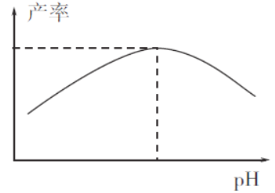
①pH过低或过高均导致产率下降,其原因是_____________________;
②柠檬酸的作用还有________________________。
(5)过程II中加入无水乙醇的目的是_______________________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_____%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化中,属于吸热反应的是( )
①液态水的汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C![]() 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g)![]() CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com