
【题目】I.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色; ③最后通入足量的SO2气体。请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________;
(2)实验③中的现象为_____;
(3)实验①中反应的离子方程式是_________________。
(4)要证明某溶液中不含Fe3+而可能含有Fe2+,进行如下实验操作时的最佳顺序为___。
①加入足量氯水 ②加入足量KMnO4溶液 ③加入少量KSCN溶液
A.①③ B.③② C.③① D.①②③
Ⅱ.某工业废水中仅含表中的离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
阳离子 | K+、Cu2+、Fe3+、 Al3+、Fe2+ |
阴离子 |
|
甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
②取少量溶液,加入KSCN溶液无明显变化。
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)③中加入少量盐酸生成无色气体的离子方程式是____________________。
(2)将③中红棕色气体(标况下)收集满一试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为___________mol/L(精确到千分位)。
(3)甲同学最终确定原溶液中所含离子是__________________。
【答案】PbO2>KMnO4>H2O2 溶液紫红色褪去,有白色沉淀生成 2MnO4—+5H2O2+6H+=2Mn2++5O2↑+8H2O C 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O 0.045 Fe2+、Cu2+ Cl-、NO3-、SO42-
【解析】
I.(1)实验①说明H2O2能被KMnO4氧化,所以氧化性:KMnO4>H2O2;实验②说明Mn2+能与PbO2反应生成KMnO4,得出氧化性:PbO2>KMnO4,综上得出,氧化性顺序是:PbO2>KMnO4>H2O2,故答案为:PbO2>KMnO4>H2O2;
(2)实验③中SO2还原性较强,能使酸性KMnO4褪色,SO2被氧化为H2SO4,H2SO4和Pb2+反应生成PbSO4白色沉淀,故答案为:溶液紫红色褪去,有白色沉淀生成;
(3)实验①是H2O2被KMnO4氧化生成氧气以及锰离子的过程,即2MnO42-+5H2O2+6H+═2Mn2++5O2↑+8H2O,故答案为:2MnO2+5H2O2+6H+═2Mn2++5O2↑+8H2O;
(4)证明某溶液中不含Fe3+而可能含有Fe2+,先加KSCN溶液无现象,排除铁离子,再加氯水观察是否为血红色,实验操作时的最佳顺序为③加少量KSCN溶液、①加入足量氯水,若溶液先无现象,后为血红色,则含亚铁离子,故答案为:C;
Ⅱ.①用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察),说明没有K+;
②取少量溶液,加入KSCN溶液无明显变化,说明没有Fe3+;
③另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变,说明 Fe2+与NO3-和H+反应生成NO,即溶液中有Fe2+、NO3-,加盐酸溶液中阴离子种类不变,说明原溶液中有Cl-,加盐酸溶液依然澄清,说明没有SiO32-;
④向③中所得的溶液中加入BaCl2溶液,有白色沉淀生成,说明有SO42-;
(1)③中加入少量盐酸生成无色气体,是Fe2+与NO3-和H+反应生成NO,其离子方程式:3Fe2++NO3-+4H+═3Fe3++NO+2H2O,故答案为:3Fe2++NO3-+4H+═3Fe3++NO+2H2O;
(2)标准状况下,将一充满NO2气体的试管,倒扣于水中,3NO2 + H2O =2HNO3 + NO,至液面不再升高时,得到硝酸溶液,设试管体积为VL,最终试管中所得溶液的浓度为 =0.045mol/L,故答案为:0.045;
=0.045mol/L,故答案为:0.045;
(3)由以上推断可知溶液中阴离子为 Cl-、NO3-、SO42-,且各为0.1mol/L,已经推断出的阳离子是Fe2+,其浓度为0.1mol/L,由电荷守恒可知溶液中还有一种+2价阳离子,所以还有Cu2+,所以甲同学最终确定原溶液中所含阳离子是:Fe2+、Cu2+;阴离子是:Cl-、NO3-、SO42-,故答案为:Fe2+、Cu2+;Cl-、NO3-、SO42-。


科目:高中化学 来源: 题型:
【题目】有关下列四个常用电化学装置的叙述中正确的是
A.图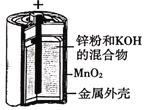 所示电池中,负极电极反应为Zn-2e-=Zn2+
所示电池中,负极电极反应为Zn-2e-=Zn2+
B.图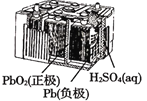 所示电池放电过程中,两电极质量不断增大
所示电池放电过程中,两电极质量不断增大
C.图 所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
所示装置工作过程中,电解质溶液中Cu2+浓度始终不变
D.图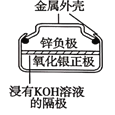 所示电池工作过程中Ag2O被氧化为Ag
所示电池工作过程中Ag2O被氧化为Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备金属铝的主要原料.工业上提取铝的工艺流程如下:
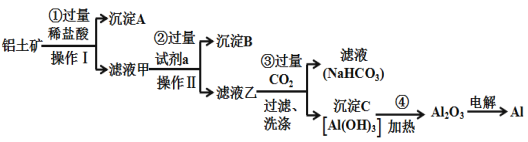
(1)沉淀A的化学式是_________,试剂a的化学式为______________;
(2)步骤③中通入过量CO2,产生沉淀C的离子方程式为______________________________________;
(3)Al2O3中所含的化学键的类型为___________________;
(4)工业上用电解熔融Al2O3的方法制备金属铝,其阳极反应式为______________________________;
(5)在生活中,常利用Al与Fe2O3间的铝热反应来进行焊接钢轨。除了Fe2O3,铝粉还可以与很多金属氧化物组成铝热剂。下列氧化物中不能与铝粉组成铝热剂的是(___________)
a MgO b V2O 5 c Fe3O4 d MnO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Q、W、X、Y、Z都是短周期主族元素,X、Y、Q在周期表中的位置关系如图所示,W、Z的最外层电子数相同,Z的核电荷数是W的2倍,则下列说法不正确的是( )
ⅠA | ⅡA | ⅢA | ⅣA |
Q | |||
X | Y |
A.非金属性:![]()
B.原子半径:![]()
C.最高价氧化物对应水化物的碱性:![]()
D.最简单氢化物的稳定性:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(14分)溴苯是一种化工原料,实验室合成溴苯的装置示意图及有关数据如下:
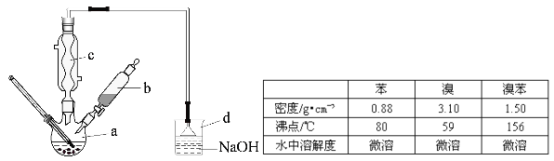
按下列合成步骤回答问题:
(1)在a中加入15mL无水苯和少量铁屑,在b中小心加入4.0mL液态溴,向a中滴入几滴溴,有白色烟雾产生,是因为生成了 气体。继续滴加至液溴滴完,装置d的作用是 ;
(2)液溴滴完后,经过下列步骤分析提纯:
①向a中加入10mL水,然后过滤除去未反应的铁屑;
②滤液依次用10mL水、8mL10%的NaOH溶液、10mL水洗涤。NaOH溶液洗涤的作用是 ③向分出的粗溴苯中加入少量的无水氯化钙,静置、过滤,加入氯化钙的是 ;
(3)经以上分离操作后,粗溴苯中还含有的主要杂质为 ,要进一步提纯,下列操作中必须的是 (填入正确选项前的字母);
A.重结晶 B.过滤 C.蒸馏 D.萃取
(4)在该实验中,a的容积最适合的是 (填入正确选项前的字母)。
A.25mL B. 50mL C.250mL D.500mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将0.03molCl2缓缓通入1L含有0.02molH2SO3和0.02molHBr的混合液中(K1、K2分别表示H2SO3的一、二级电离常数;-lg0.02=1.7),下列图象错误的是( )
A.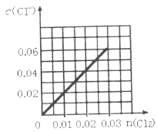 B.
B.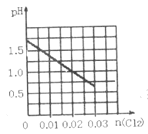
C.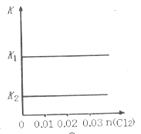 D.
D.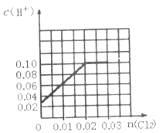
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)俗称保险粉,是白色砂状或淡黄色粉末状固体,易溶于水、不溶于醇,该物质具有强还原性,在空气中易被氧化为NaHSO4,75℃以上会分解产生SO2。是重要的有机合成原料和漂白剂。
制取Na2S2O4常用甲酸钠法:控制温度60~70℃,在甲酸钠(HCOONa)的甲醇溶液中,边搅拌边滴加Na2CO3甲醇溶液,同时通入SO2,即可生成Na2S2O4。反应原理如下:2HCOONa+4SO2+Na2CO3=2Na2S2O4+H2O+3CO2
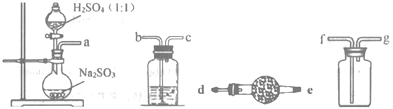
(1)如图,要制备并收集干燥纯净的SO2气体,接口连接的顺序为:a接__,__接__,__接__。制备SO2的化学方程式为___。
(2)实验室用图装置制备Na2S2O4。

①Na2S2O4中硫元素的化合价为___。
②仪器A的名称是___。
③水浴加热前要通一段时间N2,目的是___。
④为得到较纯的连二亚硫酸钠,需要对在过滤时得到的连二亚硫酸纳进行洗涤,洗涤的方法是___。
⑤若实验中所用Na2SO3的质量为6.3g,充分反应后,最终得到mg纯净的连二亚硫酸钠,则连二亚硫酸钠的产率为___(用含m的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25 ℃时有关弱酸的电离平衡常数见下表:
弱酸化学式 | HA | H2B |
电离平衡常数(25 ℃) | Ka=1.7×10-6 | Ka1=1.3×10-3 Ka2=5.6×10-8 |
则下列有关说法正确的是( )
A.NaHB溶液中部分微粒浓度的大小为:c(Na+)>c(HB-)>c(B2-)>c(H2B)
B.等物质的量浓度的各溶液pH关系为:pH(Na2B)>pH(NaHB)>pH(NaA)
C.向Na2B溶液中加入足量的HA溶液发生反应的离子方程式为:B2-+2HA=2A-+H2B
D.将a mol/L的HA溶液与a mol/L的NaA溶液等体积混合,混合液中:c(Na+)>c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 三种晶体,分别由
三种晶体,分别由![]() 、
、![]() 、
、![]() 、
、![]() 四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
四种元素中的一种或几种形成,对这三种晶体进行实验,结果如表所示。
晶体 | 熔点/℃ | 硬度 | 水溶性 | 导电性 | 水溶液与 |
| 801 | 较大 | 易溶 | 水溶液(或熔融)导电 | 白色沉淀 |
| 3500 | 很大 | 不溶 | 不导电 | 不反应 |
|
| 很小 | 易溶 | 液态不导电 | 白色沉淀 |
(1)晶体的化学式分别为![]() ______;
______;![]() ______。
______。
(2)晶体的类型分别为![]() ______;
______;![]() ______,
______,![]() ______。
______。
(3)![]() 、
、![]() 晶体中粒子间的作用力分别为______、______。
晶体中粒子间的作用力分别为______、______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com