
| |||||||||||||||||||||||||||||
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
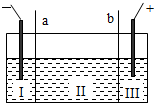 则以下叙述正确的是
则以下叙述正确的是查看答案和解析>>
科目:高中化学 来源:黄冈重点作业·高二化学(下) 题型:013
在一定条件下,萘可以被硝硫混酸硝化生成二硝基物,它是1,5-二硝基萘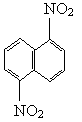 和1,8-二硝基萘
和1,8-二硝基萘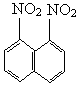 的混合物.后者可溶于溶质质量分数大于98%的硫酸,而前者不能.利用这一性质可以将这两种异构体分离.将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是
的混合物.后者可溶于溶质质量分数大于98%的硫酸,而前者不能.利用这一性质可以将这两种异构体分离.将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是
[ ]
查看答案和解析>>
科目:高中化学 来源:2001~2002学年度第二学期形成性练习 题型:038
含有![]() 、石英的石灰石1g,加入浓盐酸5g,溶质质量分数为36%.经充分反应、过滤后,得到0.29g不溶物和5.38g溶液.求石灰石中
、石英的石灰石1g,加入浓盐酸5g,溶质质量分数为36%.经充分反应、过滤后,得到0.29g不溶物和5.38g溶液.求石灰石中![]() 的质量分数.
的质量分数.
查看答案和解析>>
科目:高中化学 来源:闵行区模拟 题型:问答题
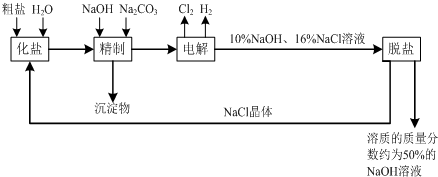
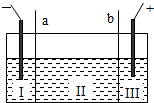
查看答案和解析>>
科目:高中化学 来源:2008年上海市闵行区高考化学模拟试卷(解析版) 题型:填空题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com