
分析 (1)根据m=nM计算二氧化碳质量,根据N=nNA计算二氧化碳分子数目;根据n=$\frac{N}{{N}_{A}}$计算水的物质的量,再根据m=nM计算水的质量;
(2)根据n=cV计算Na2CO3的物质的量,再根据m=nM计算Na2CO3的质量;
(3)硫酸分子中含有硫原子物质的量等于硫酸的物质的量,还原H原子物质的量为硫酸的2倍,根据N=nNA计算含有氢原子数目.
解答 解:(1)0.5mol CO2的质量是0.5mol×44g/mol=22g,约含有CO2分子数目为0.5mol×6.02×1023mol-1=3.01×1023,
1.204×1024个H2O分子的物质的量是$\frac{1.204×1{0}^{24}}{6.02×1{0}^{23}mo{l}^{-1}}$=2mol,质量是2mol×18g/mol=36g,
故答案为:22g;3.01×1023;2mol;36g;
(2)100mL 5mol/LNa2CO3溶液中所含Na2CO3的物质的量是0.1L×5mol/L=0.5mol,Na2CO3的质量是0.5mol×106g/mol=53g,
故答案为:0.5mol;53g;
(3)1mol H2SO4中含硫原子为1mol×1=1mol,含有氢原子数目为1mol×2×6.02×1023mol-1=3.01×1023=1.204×1024,
故答案为:1;1.204×1024.
点评 本题考查物质的量有关计算,比较基础,注意掌握以物质的量为中心计算,有利于基础知识的巩固.


科目:高中化学 来源: 题型:选择题
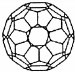
| A. | C60就是金刚石 | B. | C60属于有机化合物 | ||
| C. | C60的摩尔质量是720g/mol | D. | 1mol C60完全燃烧生成22.4L CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 最外层有6个电子 | B. | 位于元素周期表的第七周期 | ||
| C. | 主要化合价为-4价、+4价 | D. | “类铅”不能和盐酸反应放出氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向HNO2溶液中加入NaNO2固体,pH变大 | |
| B. | 用HNO2溶液做导电性实验,灯泡很暗 | |
| C. | 0.1mol•L-1的HNO2溶液的pH=2 | |
| D. | pH=3的HNO2溶液稀释至100倍后,3<pH<5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
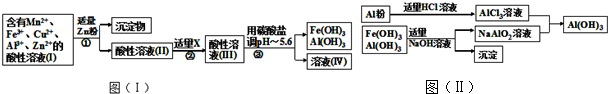
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
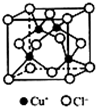 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com