
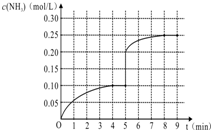
 ��һ�ݻ�Ϊ1L���ܱ������ڼ���0.1mol��N2��0.3mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ��
��һ�ݻ�Ϊ1L���ܱ������ڼ���0.1mol��N2��0.3mol��H2����һ�������·������·�Ӧ��N2��g��+3H2��g��?2NH3��g����H��0����Ӧ��NH3�����ʵ���Ũ�ȵı仯�����ͼ������ ��1����ѧƽ�ⳣ��K����������Ũ����֮���뷴Ӧ��Ũ����֮���ıȣ�
��2���ȼ��㰱����Ӧ���ʣ��ٸ���ͬһ���淴Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȼ��㵪����Ӧ���ʣ�
��3�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��4���ı�������һ˲�䣬����Ũ���������ŷ�Ӧ�Ľ��У�����Ũ������ƽ�������ƶ���
��� �⣺��1���÷�Ӧ��ѧƽ�ⳣ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$��
�ʴ�Ϊ��K=$\frac{{c}^{2}��N{H}_{3}��}{c��{N}_{2}����{c}^{3}��{H}_{2}��}$��
��2��v��NH3��=$\frac{0.10-0}{4}$mol/��L��min��=0.025 mol/��L•min����ͬһ���淴Ӧ��ͬһ��ʱ���ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ�����v��N2��=$\frac{1}{2}$ v��NH3��=$\frac{1}{2}$��0.025 mol/��L•min��=0.0125 mol/��L•min����
�ʴ�Ϊ��0.0125 mol/��L•min����
��3��a��N2��NH3Ũ�����ʱ���÷�Ӧ��һ���ﵽƽ��״̬���뷴Ӧ��ʼŨ�ȼ�ת�����йأ����Բ��ܾݴ��ж�ƽ��״̬���ʴ���
b��NH3�ٷֺ������ֲ���ʱ�����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬������ȷ��
c�������������ѹǿ����ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ������䣬��Ӧ�ﵽƽ��״̬������ȷ��
d����2v����H2��=32v����NH3�� ʱ��Ӧ�ﵽƽ��״̬�����Ե� 3v����H2��=2v����NH3��ʱ��Ӧû�дﵽƽ��״̬���ʴ���
��ѡ��b��c��
��4���ı�������һ˲�䣬����Ũ���������ŷ�Ӧ�Ľ��У�����Ũ������ƽ�������ƶ���ֻ��������ѹǿƽ�������ƶ����ʴ�Ϊ������ѹǿ��
���� ���⿼�黯ѧƽ����㡢��ѧƽ��״̬�жϡ���ѧƽ��Ӱ�����ص�֪ʶ�㣬���ؿ���ѧ�������жϼ���������������Ӧǰ��ı������������ʱ�����淴Ӧ�ﵽƽ��״̬��ע�����ͼ�������߱仯���������Ӱ�����صĹ�ϵ����Ŀ�ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����ʯ��ˮ��ͨ������������̼��2OH?+CO2�TCO32?+H2O | |
| B�� | ������Ͷ��ˮ�з�����Ӧ��O2?+H2O�T2OH? | |
| C�� | ������Һ���뵽NaOH��Һ�У�CH3COOH+OH?�TCH3COO?+H2O | |
| D�� | ����ϡ���ᷴӦ��������2Fe+6H+�T2Fe3++3H2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �������ӳ� | B�� | ͨ����ˮ | ||
| C�� | ͨ��Ũ���� | D�� | ͨ�����������Һ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״����ڹ̶������н��У���2H2��g��+CO��g��?CH3OH��g��
�״���һ�ֿ�������Դ�����п�����Ӧ�õĹ���ǰ������ҵ��һ��ɲ������·�Ӧ���ϳɼ״����ڹ̶������н��У���2H2��g��+CO��g��?CH3OH��g��| �¶� | 250�� | 300�� | 350�� |
| K | 2.041 | 0.270 | 0.012 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | AgCl����ת��ΪAgI | |
| B�� | 25��ʱ��0.1mol/L HF��ҺpH=l | |
| C�� | 25��ʱ��ʹAgClת��ΪAgI�������KI��Һ��Ũ�Ȳ�����5��10-12mol/L | |
| D�� | ��1L0.1mol/LHF��Һ�м���1L 0.1mol/LCaCl2��Һ��û�г������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��طŵ�ʱ����ظ�����Χ��Һ��pH �������� | |
| B�� | ��س��ʱ��������ӦΪ��Ni��OH��2+OH--e-�TNiO��OH��+H2O | |
| C�� | ��س��ʱ����Ԫ�ر����� | |
| D�� | ��طŵ�ʱ��������ӦΪ��H2-2e-�T2H+ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������ͭ��Һ��Ӧ��Fe+Cu2+�TFe2++Cu | |
| B�� | ����þ��ϡ�����ϣ�MgO+H+�TMg2++H2O | |
| C�� | ̼��������ᷴӦ��CO32-+2H+�TCO2��+H2O | |
| D�� | ����������Һ��ϡ���ᷴӦ��Ba2++SO42-�TBaSO4�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | C��Na+��=2C��S2-��+2C��HS-��+2C��H2S�� | B�� | C��Na+��+C��H+��=C��OH-��+C��HS-��+C��S2-�� | ||
| C�� | C��OH-��=C��H+��+C��HS-��+2��H2S�� | D�� | C��Na+����C��S2-����C��OH-����C��HS-�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com