
| A. | 2.4g金属镁变成镁离子时失去的电子数为0.1NA | |
| B. | 标准状况下,22.4L空气含有NA个单质分子 | |
| C. | 200C,1.01×105Pa,同体积的O2、CO2含有相同的分子数 | |
| D. | 含NA个Na+的Na2O 溶解于1L水中,Na+ 的物质的量浓度为1 mol•L-1 |
分析 A、求出镁的物质的量,然后根据镁反应后变为+2价来分析;
B、空气中除了单质气体,也有化合物气体;
C、同温同压下,相同体积的任何气体的物质的量相同,而分子个数与物质的量成正比;
D、氧化钠溶于1L水中后,溶液体积大于1L.
解答 解:A、2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁反应后失去0.2NA个电子,故A错误;
B、空气中除了单质气体,也有化合物气体,故标况下22.4L空气即1mol空气中含有的单质分子个数小于NA个,故B错误;
C、根据物质的量n=$\frac{V}{Vm}$可知,20℃,1.01×105Pa,同体积的O2、CO2的物质的量相同,根据分子个数N=nNA可知,分子个数与物质的量成正比,故当物质的量相同时,分子个数也相同,故C正确;
D、氧化钠溶于1L水中后,溶液体积大于1L,则所得的溶液中钠离子的浓度小于1mol/L,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:选择题
| A. | 含有Fe3+的溶液:Na+、SCN-、Cl-、S2- | |
| B. | 含有大量NO3-的溶液:H+、SO32-、Cl-、SO42- | |
| C. | 常温下,pH=12的溶液:K+、Cl-、CO32-、AlO2- | |
| D. | 与铝反应产生无色无味气体的溶液:NO3-、K+、Cl-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.4g白磷(P4)中所包含的P-P共价键有0.6NA | |
| B. | 40 g SiC晶体中含有NA个SiC分子 | |
| C. | 1mol淀粉(C6H10O5)n水解后产生葡萄糖的分子数一定为NA | |
| D. | 标准状况下,2molNa2O2与44.8LSO2反应,转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键). .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )
用酸性氢氧燃料电池电解苦卤水(含Cl-、Br-、Na+、Mg2+)的装置如图所示(a、b为石墨电极),下列说法正确的是( )| A. | 电池工作时,正极反应式为:O2+4H++4e-═2H2O | |
| B. | 电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极 | |
| C. | 试管中NaOH溶液仅用来吸收电解时产生的Cl2 | |
| D. | 当电池中消耗2.24L(标准状况)H2时,b极周围会产生0.02mol气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
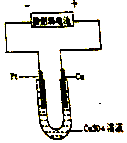 肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.
肼(N2H6)又称联氨,是一种可燃性的液体,可用作火箭燃料.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的分子个数比为17:16 | B. | 它们的原子个数比为17:16 | ||
| C. | 它们的体积比为17:16 | D. | 它们密度比为16:17 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com