
配制一定物质的量浓度的KOH溶液时,造成最终浓度偏低的原因可能是( )
|
| A. | 容量瓶事先未烘干 |
|
| B. | 定容时俯视观察液面 |
|
| C. | 未用蒸馏水洗涤烧杯 |
|
| D. | 定容后,摇匀时有少量液体流出 |
| 配制一定物质的量浓度的溶液. | |
| 专题: | 化学实验基本操作. |
| 分析: | 根据c= |
| 解答: | 解:A、容量瓶事先未烘干,由于定容还需要加入蒸馏水,所以不影响溶质的物质的量和溶液的体积,即不影响配制结果,故A错误; B、定容时俯视观察液面,导致加入的蒸馏水体积偏小,根据c= C、未用蒸馏水洗涤烧杯,导致配制溶液中溶质的物质的量偏小,根据c= D、定容后,摇匀时有少量液体流出,由于溶液的均一性,所以不影响配制结果,故D错误; 故选C. |
| 点评: | 本题考查了配制一定物质的量浓度的溶液的误差分析,该题是中等难度的试题,试题基础性强,贴近高考,侧重对学生能力的培养和解题方法的指导和训练,注意明确误差分析的方法与技巧. |


科目:高中化学 来源: 题型:
银锌纽扣电池工作时的反应为:Zn+Ag2O+H2O=Zn(OH)2+2Ag,下列说法不正确的是( )
|
| A. | 锌是阴极,Ag2O是阳极 |
|
| B. | 电解质溶液为碱溶液,不可能是强酸溶液 |
|
| C. | 锌电极的反应式为:Zn+2OH﹣﹣2e﹣=Zn(OH)2 |
|
| D. | 若工作时转移电子0.2mol,则消耗Zn的质量为6.5g |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列化学反应在金属冶炼工业中还没有得到应用的是
( )
A.2NaCl(熔融) 2Na+Cl2↑
2Na+Cl2↑
B.Al2O3+3C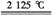 2Al+3CO↑
2Al+3CO↑
C.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
D.2Ag2O 4Ag+O2↑
4Ag+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
金属a、b的活泼性均比氢强,a还可以从b的硝酸盐中置换出b。将a、b用导线相连放入CuSO4溶液,下列叙述中不正确的是( )
A.导线上有电流,电流方向由b向a
B.a极质量减小,b极质量增加
C.b极上放出氢气
D.a极发生氧化反应,b极发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,不属于四种基本反应类型是( )
|
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | 2HClO═2HCl+O2↑ |
|
| C. | Fe+2FeCl3═3FeCl2 | D. | CuO+CO |
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中只含有Na+、Al3+、Cl﹣、SO42﹣ 四种离子,已知前三种离子的个数比为3:2:1,则溶液中Al3+和 SO42﹣的离子个数比为( )
|
| A. | 1:2 | B. | 1:4 | C. | 3:4 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
向含有下列离子的溶液中分别加入烧碱固体(溶液体积变化可忽略),能引起离子浓度减小的是( )
|
| A. | CO32﹣ | B. | Cl﹣ | C. | OH﹣ | D. | Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
绿色化学的核心是反应过程的绿色化,要求原料物质中的所有原子完全被利用且全部转入期望的产品中.下列过程不符合这一思想的是( )
|
| A. | 甲烷、CO合成乙酸乙酯:2CH4+2CO |
|
| B. | 烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+H2 |
|
| C. | 乙醇被氧气催化氧化成乙醛 |
|
| D. | 氯乙烯合成聚氯乙烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
教材中用酸性KMnO4和H2C2O4(草酸)反应研究影响反应速率的因素,离子方程式为:2MnO4﹣+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O.一实验小组欲通过测定单位时间内生成CO2的速率,探究某种影响化学反应速率的因素,设计实验方案如下(KMnO4溶液已酸化):
| 实验序号 | A溶液 | B溶液 |
| ① | 20mL 0.1mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
| ② | 20mL 0.2mol•L﹣1 H2C2O4溶液 | 30mL 0.01mol•L﹣1 KMnO4溶液 |
(1)该实验探究的是 因素对化学反应速率的影响.相同时间内针筒中所得CO2的体积大小关系是 > (填实验序号).
(2)若实验①在2min末收集了4.48mL CO2(标准状况下),则在2min末,c(MnO4﹣)= mol/L.
(3)除通过测定一定时间内CO2的体积来比较反应速率,本实验还可通过测定 来比较化学反应速率.
(4)小组同学发现反应速率总是如图二,其中t1~t2时间内速 率变快的主要原因可能是:①该反应放热、② .

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com