
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ•mol-1 | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2(g)△H=-192.9 kJ•mol-1 则CH3OH(g)的燃烧热为192.9 kJ•mol-1 | |
| C. | 葡萄糖的燃烧热是2800 kJ•mol-1,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1 | |
| D. | H2(g)的燃烧热是285.8 kJ•mol-1,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ•mol-1 |
分析 A.钡离子与硫酸根离子结合生成硫酸钡沉淀也放出热量;
B.甲醇的燃烧热应是1mol甲醇完全燃烧生成二氧化碳气体与液态水放出的热量;
C.葡萄糖的燃烧热是2800 kJ•mol-1,则1mol葡萄糖完全燃烧生成二氧化碳气体与液态水放出的热量为2800kJ,则0.5mol葡萄糖放出的为1400kJ,标明物质的聚集状态,反应放热,焓变符号为“-”;
D.H2(g)的燃烧热是285.8 kJ•mol-1,则1mol氢气燃烧生成液态水放出的热量为285.8kJ,气态水的能量比较液态水的能量高.
解答 解:A.钡离子与硫酸根离子结合生成硫酸钡沉淀也放出热量,H2SO4和Ba(OH)2反应的反应热△H<2×(-57.3)kJ•mol-1,故A错误
B.甲醇的燃烧热应是1mol甲醇完全燃烧生成二氧化碳气体与液态水放出的热量,故B错误;
C.葡萄糖的燃烧热是2800 kJ•mol-1,则1mol葡萄糖完全燃烧生成二氧化碳气体与液态水放出的热量为2800kJ,则0.5mol葡萄糖放出的为1400kJ,则$\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ•mol-1,故C正确;
D.H2(g)的燃烧热是285.8 kJ•mol-1,则1mol氢气燃烧生成液态水放出的热量为285.8kJ,气态水的能量比较液态水的能量高,故2H2O(g)═2H2(g)+O2(g)的△H<571.6 kJ•mol-1,故D错误,
故选:C.
点评 本题考查反应热计算、热化学方程式书写、燃烧热等,注意燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 减少对大气的污染 | B. | 降低成本 | ||
| C. | 防止石油短缺 | D. | 加大发动机的动力 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数越大,原子半径一定越大 | |
| B. | 电子层数多的原子的半径一定比电子层数少的大 | |
| C. | 原子序数大的原子,最外层电子数越多 | |
| D. | 元素原子最外层电子数越多(除稀有气体),可显示的化合价不一定越高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| ①在含B的溶液中加入稀H2SO4,产生浅黄色浑浊和使澄清石灰水变浑浊的无色有刺激性气味的气体 |
| ②20mL沸水中滴加F的饱和溶液1~2mL所得液体呈红褐色 |
| ③将实验②得到的红褐色液体加热蒸发,灼烧,最终得到红棕色固体 |
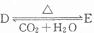 ,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.
,若有D和E•xH2O的混合物13.04g,加热到完全反应后,气体产物通过浓H2SO4增重3.42g,剩余气体通过碱石灰增生2.20g,则E•xH2O的化学式为Na2C03•7H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
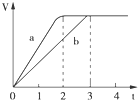 镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )
镁粉和铝粉分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)关系如图,下列说法正确的是( )| A. | 镁粉和铝粉的物质的量之比为3:2 | |
| B. | 镁粉和铝粉质量之比为3:2 | |
| C. | 镁粉和铝粉的摩尔质量之比为2:3 | |
| D. | 镁粉和铝粉反应完所需时间之比为3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
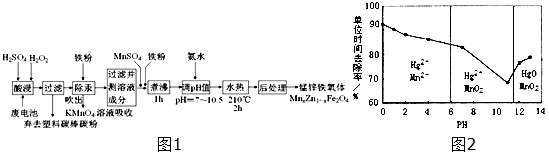
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com