
| x的取值 | 固体成分 | 气体成分 | |
| A | 0<x<1/2 | Na2CO3 | H2O(g)、O2、CO2 |
| B | x=1/2 | Na2CO3 | H2O(g)、O2 |
| C | 1/2<x≤1 | Na2CO3、NaOH | H2O(g)、O2 |
| D | x>1 | Na2CO3、NaOH、Na2O2 | O2 |
| A、A | B、B | C、C | D、D |
| ||
| ||
| 1 |
| 2 |
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| ||
| ||
| 1 |
| 2 |
| ||
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| A、0.3molFeO与含0.6molHNO3的稀硝酸 |
| B、0.1molCu与含1molH2SO4的稀硫酸 |
| C、1molCu与含4molHNO3的浓硝酸共热 |
| D、1molMnO2与含4molHCl的浓盐酸共热 |
查看答案和解析>>
科目:高中化学 来源: 题型:
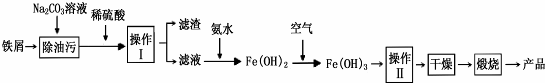
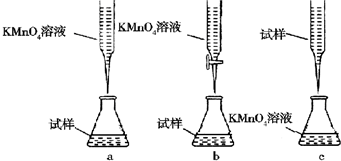
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
. |
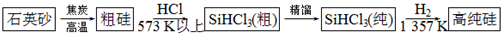
查看答案和解析>>
科目:高中化学 来源: 题型:
A、b<
| ||
B、b<
| ||
C、b>
| ||
D、b>
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、这种纳米材料属于胶体,具有丁达尔效应 |
| B、聚乙烯塑料能使酸性高锰酸钾溶液褪色 |
| C、聚乙炔导电塑料结构似金属,存在阳离子和自由电子 |
| D、这种材料不属于新型无机非金属材料 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com