


科目:高中化学 来源: 题型:
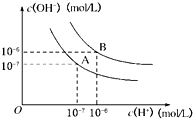 (2006?成都模拟)水的电离平衡曲线如图所示:
(2006?成都模拟)水的电离平衡曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素代号 | A | B | C | D | E | F | G |
| 化合价 | -2 | -1 | -2、+6 | +4、-4 | +3 | +1 | +4、-4 |
| 原子半径(nm) | 0.074 | 0.099 | 0.102 | 0.117 | 0.143 | 0.186 | 0.077 |
查看答案和解析>>
科目:高中化学 来源:2014届四川省雅安市高二下学期期末检测化学试卷(解析版) 题型:选择题
用铁片与0.1mol/L硫酸反应制氢气时,下列措施不能使氢气生成速率加大的是
A.改用98%浓硫酸 B.加热
C.改用2mol/L硫酸 D.把铁片换成铁粉
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com