
【题目】室温下,关于pH=11的NH3·H2O溶液,下列分析正确的是
A.c(NH3·H2O)=103mol·L1
B.加入少量水,溶液中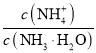 增大
增大
C.由水电离产生的c(OH)=1×1011mol·L1
D.加入等体积pH=3的盐酸,所得溶液:c(Cl)>c(NH4+)>c(H+)>c(OH)
【答案】BC
【解析】
A.一水合氨是弱电解质,部分电离,所以pH=11的NH3·H2O溶液中c(NH3H2O)>10-3molL-1,故A错误;
B.一水合氨溶液中存在电离平衡NH3·H2O![]() NH4++OH-,加入水促进一水合氨的电离,铵根离子增多,一水合氨减少,溶液中
NH4++OH-,加入水促进一水合氨的电离,铵根离子增多,一水合氨减少,溶液中 比值增大,故B正确;
比值增大,故B正确;
C.溶液中H+全部来自于水的电离,所以pH=11的NH3·H2O溶液中由水电离出的c(H+)等于由水电离出的c(OH),因此c(OH)=10-11molL-1,故C正确;
D.pH=3的盐酸浓度小于pH=11氨水浓度,二者等体积混合后氨水过量,溶液呈碱性,c(H+)<c(OH-),根据电荷守恒得c(Cl-)<c(NH4+),但是一水合氨电离程度较小,所以存在c(NH4+)>c(Cl-)>c(OH-)>c(H+),故D错误;
故选BC。


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:
【题目】(1)NaOH的摩尔质量为:__________ 。
(2)24.5克H2SO4的物质的量为:___________。
(3)标况下,8.96LCO2的质量为:___________。
(4)含3.01×1023个N原子的NH3在标况下的体积为:_____________ 。
(5)3g金属锌与足量的稀硫酸反应可生成标况下的氢气体积为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol过氧化钠与1.6mol碳酸氢钠固体混合后,在密闭的容器中加热充分反应,排出气体物质后冷却,残留的固体物质是 ( )
A. Na2CO3 B. NaOH、Na2CO3 C. Na2O2、 Na2CO3 D. Na2O2、 NaOH 、Na2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、将 5 g 钠铝合金投入到 200 mL 的水中,固体完全溶解,产生 4.48 L 标准状况下的气体,溶液中只有一种溶质。经过分析得出钠铝合金中两种金属的物质的量之比为_______,所得溶液中溶质的物质的量浓度为__________(假设溶液体积变化忽略不计)。
Ⅱ、把由 NaOH、AlCl3、MgCl2 三种固体组成的混合物溶于足量水中,有 0.58 g 白色难溶物析出,向所 得溶液中逐滴加人 0.5 mol L-1 的盐酸,加入盐酸的体积和生成沉淀的质量如下图所示:
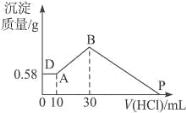
请计算:
(1)混合物中 MgCl2 的质量__________g;
(2)P 点表示盐酸加入的体积_________ml。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl晶体中Na+与Cl-都是等距离交错排列,若食盐的密度是2.2 g·cm-3,阿伏加德罗常数6.02×1023mol-1,食盐的摩尔质量为58.5 g·mol-1。则食盐晶体中两个距离最近的钠离子中心间的距离是多少?_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用有机含碘![]() 主要以I2和IO3-的形式存在
主要以I2和IO3-的形式存在![]() 废水制备单质碘的实验流程如下:
废水制备单质碘的实验流程如下:
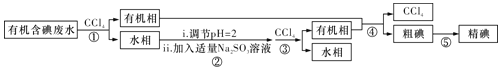
已知:Ⅰ.碘的熔点为113℃,但固态的碘可以不经过熔化直接升华;
Ⅱ.粗碘中含有少量的硫酸钠杂质。
下列说法正确的是( )
A.操作②中发生反应的离子方程式为IO3-+3SO32-=I-+3SO42-
B.操作①和③中的有机相从分液漏斗上端倒出
C.操作④为过滤
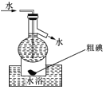
D.操作⑤可用如图所示的水浴装置进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十八大以来,各地重视“蓝天保卫战”战略。作为煤炭使用大国,我国每年煤炭燃烧释放出的大量SO2严重破坏生态环境。现阶段主流煤炭脱硫技术通常采用石灰石-石膏法将硫元素以CaSO4的形式固定,从而降低SO2的排放。但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低脱硫效率。相关反应的热化学方程式如下:
反应Ⅰ:CaSO4(s)+CO(g) ![]() CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
CaO(s) + SO2(g) + CO2(g) 活化能Ea1,ΔH1=218.4kJ·mol-1
反应Ⅱ:CaSO4(s)+4CO(g) ![]() CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
CaS(s) + 4CO2(g) 活化能Ea2,ΔH2= -175.6kJ·mol-1
请回答下列问题:
(1)反应CaO(s)+3CO(g)+SO2(g)CaS(s)+3CO2(g);△H=__________kJmol-1;该反应在________(填“高温”“低温”“任意温度”)可自发进行。
(2)恒温密闭容器中,加入足量CaSO4和一定物质的量的CO气体,此时压强为p0。tmin中时反应达到平衡,此时CO和CO2体积分数相等,CO2是SO2体积分数的2倍,则反应I的平衡常数Kp=________(对于气相反应,用某组分B的平衡压强p(B)代替物质的量浓度c(B)也可表示平衡常数,记作Kp,如p(B)=p·x(B),p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。
(3)图1为1000K时,在恒容密闭容器中同时发生反应I和II,c(SO2)随时间的变化图像。请分析图1曲线中c(SO2)在0~t2区间变化的原因___________________。

(4)图2为实验在恒容密闭容器中,测得不同温度下,反应体系中初始浓度比![]() 与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
与SO2体积分数的关系曲线。下列有关叙述正确的是______________________。
A.当气体的平均密度不再变化,反应I和反应Ⅱ同时达到平衡状态
B.提高CaSO4的用量,可使反应I正向进行,SO2体积分数增大
C.其他条件不变,升高温度,有利于反应I正向进行,SO2体积分数增大,不利于脱硫
D.向混合气体中通入氧气(不考虑与SO2反应),可有效降低SO2体积分数,提高脱硫效率
(5)图1中,t2时刻将容器体积减小至原来的一半,t3时达到新的平衡,请在图1中画出t2-t3区间c(SO2)的变化曲线__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
研究发现,在CO2低压合成甲醇反应(CO2+3H2=CH3OH+H2O)中,Co氧化物负载的Mn氧化物纳米粒子催化剂具有高活性,显示出良好的应用前景。回答下列问题:
(1)Co基态原子核外电子排布式为_____________。元素Mn与O中,第一电离能较大的是_________,基态原子核外未成对电子数较多的是_________________。
(2)CO2和CH3OH分子中C原子的杂化形式分别为__________和__________。
(3)在CO2低压合成甲醇反应所涉及的4种物质中,沸点从高到低的顺序为_________,原因是______________________________。
(4)硝酸锰是制备上述反应催化剂的原料,Mn(NO3)2中的化学键除了σ键外,还存在________。
(5)MgO具有NaCl型结构(如图),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________nm。MnO也属于NaCl型结构,晶胞参数为a' =0.448 nm,则r(Mn2+)为________nm。
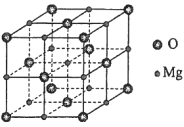
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气、氯气是中学实验室常见气体,在实验室可以利用该反应2KMnO4+16HCl(浓)→2KCl+2MnCl2+5Cl2↑+8H2O,制备Cl2,并在实验室模拟工业制备盐酸,请回答下列问题:
(1)甲组同学用下列装置制取H2和Cl2。
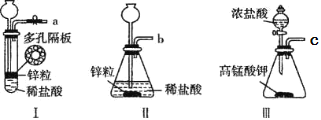
①实验室常用NaCl+H2SO4(浓)→NaHSO4+HCl↑反应制备HCl气体,该反应利用了浓硫酸的___性。
②用工业级锌粒(主要成分 Zn,含少量 FeS、Pb、Cu 等杂质)作原料,装置 I、Ⅱ均可以制取 H2,但装置 I 比装置Ⅱ更好,理由__________________________;检验氯气所用的试纸是_______________。
(2)乙组同学拟用甲组的装置 I、Ⅲ及下列装置(可以重复选用)模拟工业上制取盐酸。
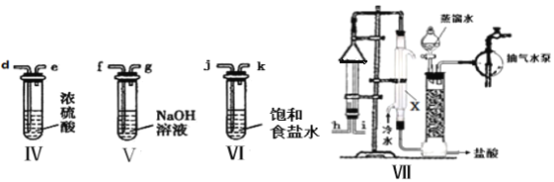
①乙组中氢气的部分实验装置连接是a-f-g-d……,其中装置Ⅴ的作用是_______,制取氯气并模拟合成盐酸的实验装置的合理连接顺序(用玻璃接口表示)为 c-__________。
②装置VII中仪器 X 的名称是_________ ,合成 HCl时需控制H2的体积略大于Cl2的体积,其目的是 ________;装置VII末端接抽气水泵的目的是___________。
(3)设计实验证明HCl极易溶于水且水溶液呈酸性:_____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com