
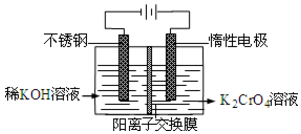
 以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:下列说法不正确的是( )| A. | 在阴极式,发生的电极反应为:2H2O+2e-=2OH-+H2↑ | |
| B. | 在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+?Cr2O72-+H2O向右移动 | |
| C. | 该制备过程总反应的化学方程式为:4K2CrO4+4H2O$\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7+4KOH+2H2↑+2O2↑ | |
| D. | 测定阳极液中K和Cr的含量,若K与Cr的物质的量之比为d,则此时铬酸钾的转化率为α=$\frac{d}{2}$ |
分析 A、阴极上得电子发生还原反应;
B、阳极上水失电子生成氧气和氢离子,氢离子浓度增大导致平衡移动,根据氢离子浓度的变化判断溶液颜色的变化;
C、电解时,铬酸钾和水放电生成重铬酸钾、氢气、氧气和氢氧化钠;
D、根据原子守恒计算其转化率.
解答 :A、根据题意可知:电极均为惰性电极,在阴极室,水得电子变成氢气,电极反应为:2H2O+2e-=2OH-+H2↑,故A正确;
B、阳极室水失去电子,电极反应为:2H2O-4e-=4H++O2↑,使阳极区氢离子浓度增大,平衡右移,故B正确;
C、总制备方程式为4K2CrO4 +4H2O $\frac{\underline{\;通电\;}}{\;}$2K2Cr2O7 +4KOH+2H2↑+O2↑,故C正确;
D、设加入反应容器内的K2CrO4为1mol,反应过程中有xmol K2CrO4转化为K2Cr2O7,则阳极区剩余K2CrO4为(1-x)mol,对应的n(K)=2(1-x)mol,n(Cr)=(1-x)mol,生成的K2Cr2O7为$\frac{x}{2}$mol,对应的n(K)=xmol,n(Cr)=xmol,根据:K与Cr的物质的量之比为d,解得x=2-d,转化率为$\frac{20-d}{1}$=2-d,故D错误;
故选D.
点评 本题考查了电解原理,难点是计算转化率,根据原子守恒即可计算其转化率,根据阴阳极上发生的反应类型写出相应的电极反应式,题目难度中等.


 全能测控一本好卷系列答案
全能测控一本好卷系列答案科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
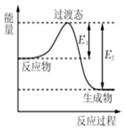 如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )
如图为1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)能量变化的示意图,已知E1=xkJ/mol,E2=ykJ/mol,下列有关说法正确的是( )| A. | 若在反应体系中加入催化剂,E1不变 | |
| B. | 活化能的大小决定了反应热的大小 | |
| C. | 该反应的活化能等于ykJ/mol | |
| D. | 1molSO2Cl2(g)和1molSCl2(g)反应生成SOCl2(g)的△H=(x-y)kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用稀硝酸清除铜镜表面的铜锈是因为稀硝酸具有强氧化性 | |
| B. | 燃料的脱硫脱氮、NO的催化转化都是减少酸雨产生的措施 | |
| C. | BaCO3难溶于水,在医学上常用作钡餐 | |
| D. | 工业上通过电解NaCl溶液制取Na |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
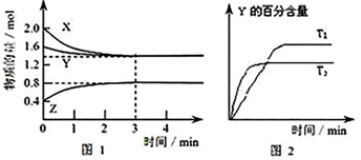
| A. | 容器中发生的反应可表示为:3X(g)+Y(g)?2Z(g) | |
| B. | 反应进行的前3 min内,用X表示的反应速率 v(X)=0.3mol/(L•min) | |
| C. | 据图2可知,相对于T1,温度为T2时更快达到“拐点”,说明T2时化学反应速率更快,可确定温度T2高于T1 | |
| D. | 若改变反应条件,使反应进程如图3所示,则改变的条件可能是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ①中Cu2S、Cu2O只作还原剂 | |
| B. | ①中每生成11.2 L气体(标准状况)转移3 mol原子 | |
| C. | 由反应②可知,在相同条件下的氧化性强弱顺序为:Zn2+>Mn2+>H+ | |
| D. | ②中阳极的电极反应式为:Mn2++2H2O-2e-═MnO2+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SiO2是酸性氧化物,能与碱溶液反应 | |
| B. | Na2CO3和NaHCO3都是盐,都能与酸溶液反应 | |
| C. | CO和NO都是大气污染物,在空气中都能稳定存在 | |
| D. | Al在浓盐酸中会“钝化”,能用铝槽盛放浓盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
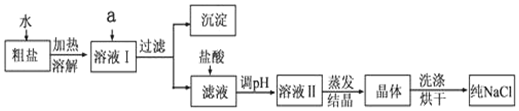
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:1:1 | B. | 2:6:3 | C. | 3:2:1 | D. | 1:3:2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com