
【题目】科学家在利用无土栽培法培养一些名贵花卉时,培养液中添加了多种必需化学元素,其配方如下:
离子 | K+ | Na+ | Mg2+ | Ca2+ | NO3— | H2PO42— | SO42— | Zn2+ |
培养液浓度(g/L) | 1 | 1 | 0.25 | 1 | 2 | 1 | 0.25 | 1 |
其中花卉根细胞吸收最少的离子是
A. Ca2+ B. SO42— C. Zn2+ D. H2PO42—
科目:高中化学 来源: 题型:
【题目】(1)氮的氧化物(NOx)是大气污染物之一,工业上在一定温度和催化剂条件下用NH3将NOx还原生成N2。某同学在实验室中对NH3与NOx反应进行了探究:收集足量NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
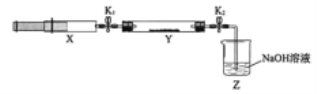
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢通入Y管中 | ①Y管中_____________ | ②反应的化学方程式 ____________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝集 |
打开K2 | ③_______________ | ④______________ |
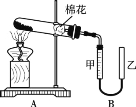
(2) 甲组同学拟用高锰酸钾制取氧气,并收集和测量氧气体积,其装置如图所示。
①读取装置B中收集到的气体体积时,需移动乙管与甲管中液面相齐,其目的是 。
②据报道高锰酸钾受热分解不产生MnO2,已知产气率=![]() ×100%。若只发生KMnO4
×100%。若只发生KMnO4![]() KMnO2+O2↑,则产气率为 。
KMnO2+O2↑,则产气率为 。
③XRD谱显示还会分解产生K2MnO4和K2Mn4O8,写出分解产生这两种物质及氧气的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及铝合金经过阳极氧化,铝表面能生成几十微米厚的氧化铝膜。某研究性学习小组模拟工业法对铝片表面进行氧化处理,按照如图所示装置连接,电解40min后取出铝片,用水冲洗,放在水蒸气中封闭处理20~30min,即可得到更加致密的氧化膜。下列有关说法正确的是

A.电解时,电子从电源负极→导线→铝极,铅极→导线→电源正极
B.在电解过程中,H+向铝片移动,SO42-向铅片移动
C.电解过程阳极周围溶液的pH下降
D.电解的总反应为2Al+6H+==2Al3++3H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Cu与一定浓度的硝酸反应时,其方程式可表示为:
Cu+HNO3→Cu(NO3)2+NO↑+NO2↑+H2O
(1)硝酸在反应中体现了__________性和__________性;
(2)0.3 mol Cu被完全溶解后,如果得到的NO和NO2物质的量相同,则参加反应的硝酸的物质的量是多少?该NO和NO2混合气体的平均相对分子质量是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据统计,金属腐蚀造成的损失远远超过火灾、水灾等自然灾害的总和,越来越被世界各国所重视,下面金属的防腐措施中,使用牺牲阳极的阴极保护法的是( )
A. 汽车底盘喷涂油漆 B. 地下钢管连接锌块
C. 钢闸门连接电源负极 D. 掺防腐的金属制成不锈钢菜刀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明缺硒可导致克山病。克山病是一种地方性心肌病,急重症病人可发生猝死。营养学和流行病学界专家认为,成人每天硒的摄取量约在40μg~100μg就可满足人体需要。根据资料,下列解释不正确的是()
A. 硒是人体必需的化学元素
B. 硒在人体生长发育过程中的作用不可替代
C. 硒的作用重大,只要有了硒,人体就能正常生长发育
D. 硒是人体必需的微量元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
① 醋酸在水溶液中的电离方程式为 。
② 下列方法中,可以使醋酸稀溶液中CH3COOH电离程度增大的是 (填字母序号)。
a.滴加少量浓盐酸 b.微热溶液
c.加水稀释 d.加入少量醋酸钠晶体
(2)用0.1 mol·L-1 NaOH溶液分别滴定体积均为20.00 mL、浓度均为0.1 mol·L-1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
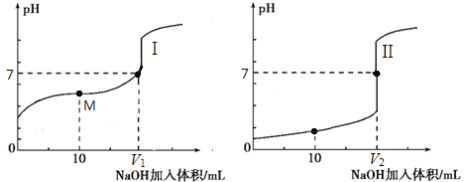
滴定醋酸的曲线是 (填“I”或“II”)。
② 滴定开始前,三种溶液中由水电离出的c(H+)最大的是 。
③ V1和V2的关系:V1 V2(填“>”、“=”或“<”)。
④ M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是 。
(3)为了研究沉淀溶解平衡和沉淀转化,某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度:AgSCN > AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol·L-1 AgNO3溶液中加入2 mL 0.005 mol·L-1 KSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol·L-1 Fe(NO3)3溶液。 | 溶液变红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol·L-1 AgNO3溶液。 | 现象a ,溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3 mol·L-1 KI溶液。 | 出现黄色沉淀。 |
写出步骤2中溶液变红色的离子方程式 。
步骤3中现象a是 。
用化学平衡原理解释步骤4的实验现象 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com