
| A. | 18g D2O和18g H2O中含有的质子数均为10NA | |
| B. | 2L 0.5 mol•L-1亚硫酸溶液中含有的H+离子数为2NA | |
| C. | 过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA | |
| D. | 标准状况下,2.24L Cl2与过量的稀FeI2溶液反应,转移电子总数为0.1NA |
分析 A、重水的摩尔质量为20g/mol;
B、亚硫酸为弱电解质,不能完全电离;
C、过氧化钠与水反应时,1mol过氧化钠~0.5mol氧气~1mol电子;
D、求出氯气的物质的量,然后根据反应后氯元素为-1价来分析.
解答 解:A、重水的摩尔质量为20g/mol,故18g重水的物质的量为0.9mol,则含有9mol质子即9NA个,故A错误;
B、亚硫酸为弱电解质,不能完全电离,故溶液中的氢离子的个数小于2NA个,故B错误;
C、过氧化钠与水反应时,1mol过氧化钠~0.5mol氧气~1mol电子,故当生成0.1mol氧气时转移0.2mol电子即0.2NA个,故C正确;
D、标况下,2.24L氯气的物质的量为0.1mol,而反应后氯元素为-1价,故0.1mol氯气转移0.2mol电子即0.2NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 小学教材全测系列答案
小学教材全测系列答案科目:高中化学 来源: 题型:选择题
| A. | 78g Na2O2固体中,含有阴阳离子总数为4NA | |
| B. | 1mol Cl2与足量烧碱完全转移电子数为2NA | |
| C. | 1mol Be2+离子中含有的电子数为4NA | |
| D. | 16g臭氧(O3)含有NA个氧原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 在溶液中加入少量新制氯水,再滴几滴KSCN溶液 | 溶液变红 | 原溶液中一定含有Fe2- |
| B | 将表面打磨过的铝丝置于浓硝酸中 | 无现象 | 铝与浓硝酸不反应 |
| C | 将鲜艳的红玫瑰置于盛有氯气的集气瓶中 | 玫瑰花褪色 | 氯气有漂白性 |
| D | 用洁净的进行铁丝蘸取某溶液进行焰色反应实验,并透过蓝色钴玻璃片观察 | 火焰呈紫色 | 原溶液中有K-,无法确定是否有Na+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 L二氧化硫中所含的氧原子数等于NA | |
| B. | 标准状况下,80 g SO3中含3NA个氧原子,体积约为22.4 L | |
| C. | 标准状况下,足量Zn与一定量的浓硫酸反应,产生22.4 L气体时,转移的电子数一定为2NA | |
| D. | 对于气态物质,体积的大小主要是由分子间距离决定的 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
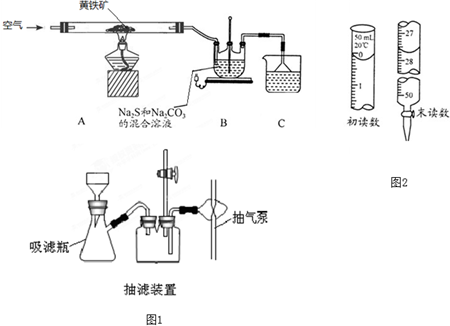

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素 | X | Y | Z | W | R |
| 相 关 信 息 | 能形成+7价的化合物 | 日常生活中常见的金属,熔化时并不滴落,好像有一层膜兜着 | 通常状况下能形成短周期中最稳定的双原子分子,它是空气的主要成分之一 | 焰色反应为黄色 | 位于第ⅣA族,是形成化合物种类最多的元素 |
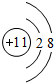
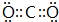
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com