
| A. | HCl | B. | Na2O2 | C. | CuO | D. | FeCl3 |
分析 单质A、B和化合物C符合下列转化关系:A+B$\stackrel{点燃}{→}$C$\stackrel{溶于水后电解(惰性气体)}{→}$A+B,从转化关系知,用惰性电极电解电解质溶液实质上是电解电解质,C可以为不活泼金属的无氧酸盐或无氧酸,但无氧酸盐中金属元素必须在金属活动性顺序表中位于H之后,据此分析解答.
解答 解:A.若C是HCl,电解盐酸溶液时,阳极上氯离子放电生成Cl2、阴极上氢离子放电生成H2,氢气在氯气中燃烧生成HCl,符合题意,故A选;
B.如果C是Na2O2,Na2O2和水反应生成NaOH和O2,电解NaOH溶液时阳极上生成O2、阴极上生成H2,氢气和氧气反应生成水而不是Na2O2,所以不符合题意,故B不选;
C.CuO不溶于水,不符合题意,故C不选;
D.电解氯化铁溶液时,阳极上生成Cl2、阴极上生成H2,氢气和氯气反应生成HCl,不符合题意,故D不选;
故选A.
点评 本题考查电解原理,为高频考点,侧重考查学生分析推断及发散思维能力,用惰性电极电解电解质溶液时,有电解电解质型、电解水型、电解电解质和水型,明确各个电极上发生的反应是解本题关键,题目难度不大.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 第七周期第IIIA族 | B. | 第七周期第VA族 | ||
| C. | 第七周期第IIIB族 | D. | 第七周期第VB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
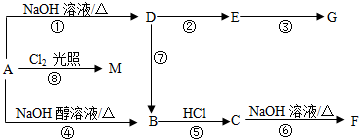
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
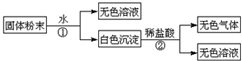
| 序号 | 化学式 |
| Ⅰ | |
| Ⅱ | |
| Ⅲ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HF溶液保存在玻璃试剂瓶中 | |
| B. | 液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封 | |
| C. | 为防止被氧化,FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 硝酸应装在棕色瓶中密封避光保存 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ | ||
| C. | S+O2$\frac{\underline{\;点燃\;}}{\;}$SO2 | D. | H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
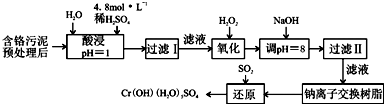
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 开始沉淀时的pH | 1.9 | 7.0 | -- | -- | 4.7 | -- |
| 沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9 (>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com