
 xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ���ǣ� ��
xC��g�� ��H��0��ƽ��ʱM��A��B��C�����ʵ���֮��Ϊ1��3��4�������жϲ���ȷ���ǣ� ��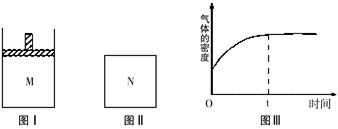
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CH3OH(g) ��H��0
CH3OH(g) ��H��0
| A��ƽ�ⳣ����K(a)��K(c) K(b)��K(d) |
| B������Ӧ���ʣ�v(a)��v(c) v(b)��v(d) |
| C��ƽ��Ħ��������M(a)��M(c) M(b)��M(d) |
| D��ƽ��ʱa��һ����n(CO)��n(H2)��1:2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2C(g)��D(g)���ﵽƽ��ʱC��Ũ��Ϊwmol/L�����¶Ⱥ�ѹǿ���䣬������������ȳ�������P�У�ƽ���C��Ũ����Ϊwmol/L����(����)
2C(g)��D(g)���ﵽƽ��ʱC��Ũ��Ϊwmol/L�����¶Ⱥ�ѹǿ���䣬������������ȳ�������P�У�ƽ���C��Ũ����Ϊwmol/L����(����)| A��6mol A��2mol B |
| B��3mol A��1mol B��2mol C |
| C��2mol C��1mol B��1mol D |
| D��1mol C��2mol D |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(��) + qQ(��)��m��n��p��qΪ��������ʱ���������һ����ƽ��״̬���ǣ�
pC(��) + qQ(��)��m��n��p��qΪ��������ʱ���������һ����ƽ��״̬���ǣ�| A���ۢܢݢ� �� | B���ڢۢܢ� | C���٢ۢܢݡ� | D���٢ۢܢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 pC(g)+qD(g) ��H��0�����н����д�����ǣ� ��
pC(g)+qD(g) ��H��0�����н����д�����ǣ� ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2HI(g) ��H =" -14.9" kJ/mol���ڼס������������ͬ�ܱ������г��뷴Ӧ����ֺ��º��ݣ�����ʼŨ�����±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)="0.008" mol/L�� �����ж���ȷ��
2HI(g) ��H =" -14.9" kJ/mol���ڼס������������ͬ�ܱ������г��뷴Ӧ����ֺ��º��ݣ�����ʼŨ�����±���ʾ�����з�Ӧ�ﵽƽ��ʱ�����c(H2)="0.008" mol/L�� �����ж���ȷ��| ��ʼŨ�� | c(H2) / mol/L | c(I2) / mol/L | c(HI) / mol/L |
| �� | 0.01 | 0.01 | 0 |
| �� | 0.02 | 0.02 | 0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2NH3������A��B��C��D�ĸ�������ÿ�������������ֲ��������ֲ����ֱ�ﵽƽ�����1��N2�Ͳ���2��NH3ת����֮��һ����Ϊ1���ǣ���ʼ�����ͬ��
2NH3������A��B��C��D�ĸ�������ÿ�������������ֲ��������ֲ����ֱ�ﵽƽ�����1��N2�Ͳ���2��NH3ת����֮��һ����Ϊ1���ǣ���ʼ�����ͬ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
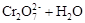

 ������˵����ȷ����
������˵����ȷ����| A�������Һ�м������ŨNaOH��Һ����Һ�ʳȺ�ɫ |
| B���÷�Ӧ����������ԭ��Ӧ |
| C�������Һ�еμ�������Ũ���ᣬƽ�����淴Ӧ�����ƶ����ٴδﵽƽ���������Ũ�ȱ�ԭ��Һ�� |
D���÷�Ӧ��ƽ�ⳣ������ʽ��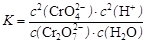 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 Z(g)��2W(g) ��H��0���ﵽƽ�⣨��ʱ��V(B)��0.8a L��
Z(g)��2W(g) ��H��0���ﵽƽ�⣨��ʱ��V(B)��0.8a L��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com