
| A. | 纯碱溶液显碱性,可用热的纯碱溶液除去金属表面的油污 | |
| B. | 明矾溶于水可形成氢氧化铝胶体,可用于自来水的杀菌消毒 | |
| C. | NH3溶于水后显碱性,在FeCl3饱和溶液中通入足量NH3可制取Fe(OH)3胶体 | |
| D. | 氢氧化铁的溶解度比氢氧化铜的小得多,可向硫酸铜溶液中加入氢氧化铁除去混有的Cu2+ |
分析 A、碳酸钠水解显碱性,水解是吸热反应,利用此点性质可以除去油污;
B、明矾只能净水不能消毒;
C、在FeCl3饱和溶液中通入足量NH3得到Fe(OH)3沉淀;
D、沉淀容易由溶解度大的向溶解度小的转化.
解答 解:A、碳酸钠水解显碱性,而水解是吸热反应,故热的纯碱溶液的水解程度更大,碱性更强,由于油脂能在碱性条件下水解,故可以用热的纯碱溶液去油污,故A正确;
B、明矾不具有强氧化性,可水解生成胶体净化水,但不能消毒杀菌,故B错误;
C、在FeCl3饱和溶液中通入足量NH3得到Fe(OH)3沉淀,应在沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体,故C错误;
D、氢氧化铁的溶解度比氢氧化铜的小得多,而沉淀容易由溶解度大的向溶解度小的转化,故沉淀容易由氢氧化铜转化为氢氧化铁,即可向硫酸铁溶液中加入氢氧化铜除去混有的Fe3+,故D错误.
故选A.
点评 本题考查了物质的用途,性质决定用途,熟悉碳酸钠、明矾的性质是解题关键,题目难度不大.


 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 其他步骤正确,滴定达到终点时,俯视读数,测得c(H+)偏大 | |
| B. | 实验测得25℃时,HgI2的Ksp=4×10-9 | |
| C. | 一定温度下,向HgI2饱和溶液中加入少量Hg(NO3)2溶液,HgI2的Ksp减小 | |
| D. | 温度不变,在t时,向HgI2饱和溶液中加入少量浓KI溶液,离子浓度变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
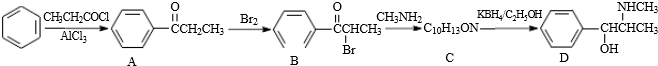
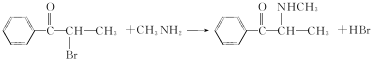 .C-D的反应类型为还原反应.
.C-D的反应类型为还原反应.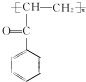
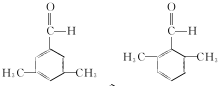 (写结构简式).
(写结构简式). 参照上述合成路线,设计一条由苯和乙酸为起始原料制备
参照上述合成路线,设计一条由苯和乙酸为起始原料制备 的合成路线:
的合成路线: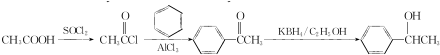 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| CH4 (g) | H2O (g) | CO (g) | H2 (g) |
| 3.0mol•L-1 | 8.5mol•L-1 | 2.0mol•L-1 | 2.0mol•L-1 |
| 实验序号 | 温度/℃ | 压强/kPa | v(CH4)/mol•L-1•s-1 | v(H2O)/mol•L-1•s-1 |
| 1 | 360 | P1 | 0.100 | 0.100 |
| 2 | 480 | 101 | 0.120 | 0.120 |
| 3 | 360 | P2 | 0.080 | 0.080 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1NH4HS溶液中有:c(NH4+)=c(HS-)+c(S2-)+c(H2S) | |
| B. | 25℃时,将a mol•L-1的氨水与0.01mol•L-1的盐酸等体积混合后,c(NH4+)=c(Cl-),则NH3•H2O的电离常数为$\frac{1{0}^{-9}}{a-0.01}$ | |
| C. | 等浓度的HCN和NaCN混合溶液中有:2c(Na+)=c(CN-)+c(HCN) | |
| D. | 等pH的①(NH4)2SO4溶液 ②NH4HSO4溶液 ③NH4Cl溶液中,c(NH4+)的大小关系:①=③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| B. | 一定条件下,铁粉可与水蒸气反应 | |
| C. | 不锈钢是铁合金,只含金属元素 | |
| D. | 纯铁的硬度和强度均高于铁合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2的水溶液能导电,所以SO2是电解质 | |
| B. | 酸式盐的水溶液呈酸性 | |
| C. | 盐类水解是中和反应的逆反应 | |
| D. | 凡是强酸生成的盐,其水溶液呈中性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com