
| A. | 利用金属钠 | B. | 利用核磁共振氢谱 | ||
| C. | 利用红外光谱法 | D. | 利用质谱法 |
科目:高中化学 来源: 题型:解答题
 Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
Ⅰ:A、B、W、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、W同周期,A、D同主族,A、W能形成两种液态化合物A2W和A2W2,E元素的周期序数与主族序数相等.
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 钢铁的电化学腐蚀过程可用原电池或电解池的原理来解释 | |
| B. | 可将河道中的钢铁闸门与外加直流电源的负极相连以保护其不受腐蚀 | |
| C. | 在钢铁表面镀锌属于牺牲阳极阴极保护法 | |
| D. | 钢铁的电化学腐蚀中,主要是吸氧腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 物质 | 类别 | 官能团 | |
| A | CH3CH=CH2 | 烯烃 |  |
| B | (CH3)2 CHCOOH | 羧酸 | -COOH |
| C | HCOOCH2- | 酯类 | -COOR |
| D | R-OH(R,烃基) | 醇类 | -OH |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 暖冰中水分子是直线型分子 | |
| B. | 水凝固形成20℃时的“暖冰”所发生的变化是化学变化 | |
| C. | 暖冰中水分子是分子密堆积 | |
| D. | 在电场作用下,水分子间更易形成氢键,因而可以制得“暖冰” |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
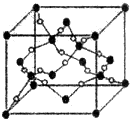 A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.
A、B、C、D、E、F、G六种元素的原子序数依次增大.A的离子和B的内层电子数相同,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,A与C能形成AC3分子且VSEPR模型为四面体形,D原子p轨道成对电子数等于未成对电子数,E原子核外每个原子轨道上的电子都已成对,F原子的最外层电子数等于其周期序数,E和F位于同一周期.G是第四周期的元素,最外层电子数与A相同且内层均填充满电子.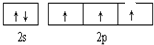 ,与AC3分子互为等电子体的阳离子为H3O+;
,与AC3分子互为等电子体的阳离子为H3O+;查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使石蕊试液呈紫色的溶液 | |
| B. | c(H+)=c(OH-)=10-6mol/L溶液 | |
| C. | pH=7的溶液 | |
| D. | 酸与碱恰好完全反应生成正盐的溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com