
| 实验步骤 | 解释或实验结论 |
| (1)称取A9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空: (1)A的相对分子质量为:90. |
| (2)将此9.0gA在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4g和13.2g. | (2)A的分子式为:C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24LCO2(标准状况),若与足量金属钠反应则生成2.24LH2(标准状况). | (3)该有机物分子中含有羟基、羧 基各1mol,羟基的电子式为 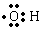 . . |
(4)A的核磁共振氢谱如图: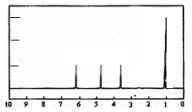 | (4)A中含有4种氢原子. |
(5)综上所述,A的结构简式 , , | |
分析 (1)有机物和氢气的密度之比等于相对分子质量之比;
(2)浓硫酸可以吸收水,碱石灰可以吸收二氧化碳,根据元素守恒来确定有机物的分子式;
(3)羧基可以和碳酸氢钠发生化学反应生成二氧化碳,羟基可以和金属钠发生化学反应生成氢气;羟基为中性原子团,其化学式中含有1个O-H键;
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比;
(5)根据A的分子式、含有官能团及含有氢原子类型情况其结构简式.
解答 解:(1)有机物质的密度是相同条件下H2的45倍,所以有机物质的分子式量为:45×2=90,
故答案为:90;
(2)浓硫酸增重5.4g,则生成水的质量是5.4g,生成水的物质的量是:$\frac{5.4g}{18g/mol}$=0.3mol,所含有氢原子的物质的量是0.6mol,碱石灰增重13.2g,所以生成二氧化碳的质量是13.2g,所以生成二氧化碳的物质的量是:$\frac{13.2g}{44g/mol}$=0.3mol,所以碳原子的物质的量是0.3mol,所以有机物中碳个数是3,氢个数是6,根据相对分子质量是90,所以氧原子个数是3,即分子式为:C3H6O3,
故答案为:C3H6O3;
(3)只有羧基可以和碳酸氢钠发生化学反应生成二氧化碳,生成2.24LCO2(标准状况),则含有一个羧基,醇羟基可以和金属钠发生反应生成氢气,与足量金属钠反应则生成2.24LH2(标准状况),则含有羟基数目是1个;羟基为中性原子团,其电子式为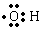 ,
,
故答案为: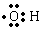 ;
;
(4)根据核磁共振氢谱图看出有机物中有4个峰值,则含4种类型的等效H原子,
故答案为:4;
(5)有机物A的分子式为C3H6O3,含有官能团为:-COOH、-OH,分子中含有4种类型的等效氢原子,氢原子的个数比是3:1:1:1,所以A的结构简式为: ,
,
故答案为: .
.
点评 本题考查有机推断,题目难度中等,根据质量守恒定律确定有机物A的分子式为解答关键,注意掌握常见有机物组成、结构与性质,试题培养了学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:解答题
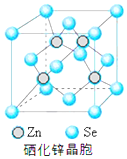 硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.
硒(Se)是一种有抗癌、抗氧化作用的元素,可以形成多种化合物.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
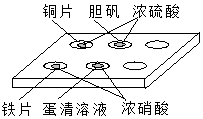 在如图所示的实验中,对点滴板上的现象描述正确的是( )
在如图所示的实验中,对点滴板上的现象描述正确的是( )| A. | ①④ | B. | ②③ | C. | ①⑤ | D. | ②⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.
文艺复兴时期,群青颜料曾用在许多著名的油画上,当时群青颜料是由贵重的青金石研磨并制成的.青金石是指碱性铝硅酸盐矿物,其中含钠、铝、硅、硫、氯、氧等元素.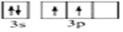 .
.| 化学式 | HClO4 | HClO3 | HClO2 | HClO |
| Ka | 1×1010 | 1×101 | 1×10-2 | 4×10-8 |
 ,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.
,HClO3中Cl原子的杂化轨道类型为sp3,HClO2中含有的共价键类型为σ键和π键.以上几种含氧酸的酸性强弱不同,其原因为几种含氧酸的酸性强弱不同,其原因为.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “冰,水为之,而寒于水”说明相同质量和温度的水和冰,冰的能量高 | |
| B. | “玉不琢不成器”,“百炼方能成钢”发生的均为化学变化 | |
| C. | “爆竹声中除旧岁,春风送暖入屠苏”爆竹爆炸发生的是分解反应 | |
| D. | “火树银花”中的焰火实质上是金属元素的焰色反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加强化石燃料的开采利用,能从根本上解决能源危机 | |
| B. | 苹果放在空气中久置变黄和纸张在空气中久置变黄原理相似 | |
| C. | 从海水中提取物质,都必须经过化学反应才能实现 | |
| D. | 焙制糕点的发酵粉主要成分之一是碳酸氢纳,它也是治疗胃酸过多的一种药剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{a}{A+n}$mol | B. | $\frac{a}{A}$mol | C. | $\frac{(A-N+m)a}{A+m}$mol | D. | $\frac{a}{A}$mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(NO3)2溶于水,可将含有Ba(NO3)2的废液倒入水槽中,再用水冲入下水道 | |
| B. | 取用细口瓶里的试液时,先拿下瓶塞,倒放在桌上,然后标签朝外拿起瓶子,瓶口要紧挨着试管口,将液体缓缓地倒入试管 | |
| C. | 胶头滴管取完一种试液后,可直接取另一种不与其反应的试液 | |
| D. | 用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却至室温才能转移到容量瓶 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com