
| A. | 标准状况下,1.12L氦气所含原子数为0.1NA | |
| B. | 1.6gNH2-离子所含质子数为NA | |
| C. | 22.4 LHCl溶于水,溶液中H+数为NA | |
| D. | 9g D216O所含的中子数为4.5 NA |
分析 A.稀有气体为单原子分子,根据标况下的气体摩尔体积计算出氦气的物质的量及含有的原子数;
B.NH2-离子含有10个电子,9个质子,根据质量计算出离子的物质的量及含有的质子数;
C.不是标准状况下,无法计算22.4L氯化氢的物质的量;
D.重水的摩尔质量为20g/mol,计算出重水的物质的量及含有的中子数.
解答 解:A.标况下,1.12L氦气的物质的量为0.05mol,含有0.05mol氦原子,所含原子数为0.05NA,故A错误;
B.1.6gNH2-离子的物质的量为0.1mol,含有0.9mol质子,所含质子数为0.9NA,故B错误;
C.不是标准状况下,不能使用标况下的气体摩尔体积计算22.4L氯化氢的物质的量,故C错误;
D.9g重水的物质的量为0.45mol,含有4.5mol中子,所含的中子数为4.5NA,故D正确;
故选D.
点评 本题考查阿伏加德罗常数的有关计算和判断,注意标准状况下条件要求及物质的状态,重水的摩尔质量为20g/mol,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:选择题
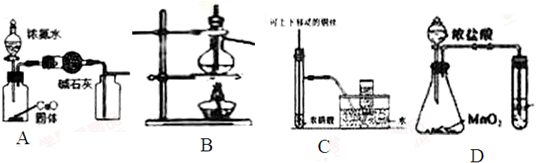
| A. | 制取并收集干燥纯净的NH3 | B. | 分离Br2和CCl4的混合物 | ||
| C. | 用于制备并收集少量NO | D. | 比较MnO2、Cl2、S 的氧化性 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
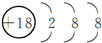 .
.| 实验步骤 | 实验现象与结论 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
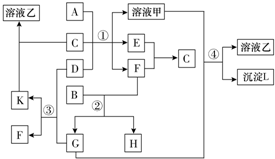
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
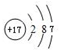
| 主族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1的NaHCO3溶液中:c(Na+)>c(HCO3-)>c(OH-)>c(H+) | |
| B. | 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+)=c(Cl-) | |
| C. | CH3CH3的二溴代烷有2种,则CH3CH3的四溴代烷也是2种 | |
| D. | 用-C3H7取代甲苯苯环上的1个氢原子,所得芳香烃的数目是三种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com